- Chi tiết
-
Được đăng: 14 Tháng 12 2018
P.H.Vân[1],7*, N.V.Thành2, T.V.Ngọc3, N.Đ.Duy4, L.T.T.Huong5, C.T.M.Thúy6,L.T.K.Thảo1, N.T.H.Thảo1, P.T.Hương8, P.Q.Camelia9, P.T.Sơn9
Tóm tắt
Đặt vấn đề: Hiện nay trong nước chưa có dữ liệu về phổ tác nhân vi sinh gây nhiễm trùng hô hấp dưới cộng đồng không phải nhập viện vì đây là các đối tượng không có chỉ định làm xét nghiệm vi sinh, trong khi đó dữ liệu như vậy lại rất cần thiết để giúp các bác sĩ cho chỉ định điều trị kháng sinh.
Mục tiêu nghiên cứu: Sử dụng phương pháp nuôi cấy và real-time PCR để phát hiện các tác nhân vi sinh gây bệnh có trong mẫu đàm tin cậy lấy từ các bệnh nhân được lâm sàng chẩn đoán nhiễm trùng hô hấp dưới cấp tính không cần nhập viện.
Đối tượng và phương pháp: Đây là nghiên cứu tiến cứu mô tả cắt ngang thực hiện đa trung tâm với sự tham gia của 4 trung tâm lâm sàng và 1 phòng thí nghiệm trung tâm. Đối tượng nghiên cứu là các bệnh nhân từ 16 tuổi trở lên được lâm sàng chẩn đoán là nhiễm trùng hô hấp dưới cấp tính không cần thiết phải nhập viện và có đủ các tiêu chuẩn đưa vào cũng như đồng ý tham gia nghiên cứu. Mẫu bệnh phẩm được làm xét nghiệm là mẫu đàm và phương pháp xét nghiệm là nuôi cấy và real-time PCR để phát hiện các tác nhân vi sinh gây bệnh. Ngoài ra mẩu quệt mũi sau cũng được lấy để làm xét nghiệm real-time PCR phát hiện tác nhân virus.
Kết quả và bàn luận: Trong thời gian từ 1/2017 đến 2/2018 đã có 157 mẫu đàm lấy từ 157 bệnh nhân được khảo sát. Phối hợp cả hai kết quả nuôi cấy và real-time PCR thì có đến 144 (91.7%) trường hợp phát hiện được tác nhân vi sinh gây bệnh trong đó phát hiện đơn tác nhân là 24 trường hợp (15.3%) với S. pneumoniae chiếm đa số là 11 (7.0%) và H. influenzae là 9 (5.7%) và phát hiện đa tác nhân trong 120 (76.4%) trường hợp với đa số là có hiện diện S. pneumoniae và hay H. influenzae hoặc là phối hợp với nhau hoặc là phối hợp với tác nhân khác. Kết quả cũng cho thấy có một tỷ lệ đáng kể phát hiện được tác nhân virus nhưng thường là phối hợp với tác nhân khác chứ rất ít khi là đơn tác nhân. Kết quả nghiên cứu cũng cho đánh giá được hiệu quả của phương pháp nuôi cấy và phương pháp vi sinh trong phát hiện các tác nhân vi sinh gây bệnh.
Kết luận: Đây là nghiên cứu đầu tiên áp dụng phương pháp nuôi cấy và real-time PCR trong phát hiện các tác nhân vi sinh gây bệnh nhiễm trùng hô hấp dưới cấp tính cộng đồng. Kết quả này là một đóng góp rất cần thiết để các nhà lâm sàng có thể sử dụng trong chỉ định kháng sinh điều trị và đồng thời cũng là bằng chứng giúp xây dựng các phát độ kháng sinh điều trị.
Microbial pathogens causing acute lower respiratory infections in out patients
The preliminary results from EACRI study
Abstract
Background: There are currently no data available on microbiological pathogens causing acute lower respiratory infections in out-patients because they are not indicated for microbiological testing, whereas such data are necessary to help the doctor to prescribe antibiotic treatment correctly
Main aims: Use of culture methods and real-time PCR to detect microbial pathogens present in reliable sputum samples that was obtained from patients who were clinically diagnosed with acute lower respiratory tract infection out-patients.
Objectives and methods: This is a cross-sectional, multicenter, prespective study with the participation of four clinical centers and one central laboratory. Patients aged 16 years and older who were clinically diagnosed with acute lower respiratory infection were not required to be admitted to the hospital and were eligible for inclusion as well as consent to participate in the study. Specimens to be tested are the sputa and the test method is culture and real-time PCR for the detection of pathogenic micro-organisms. In addition, post-nasal swab are also collected for real-time PCR detection of the virus.
Results and discussions: In the period from 1/2017 to 2/2018, 157 samples were obtained from 157 patients. Combining both culture and real-time PCR results, microbial pathogens were detected from 144 (91.7%) cases, with 24 (15.3%) were mono-pathogens in which S. pneumoniae was detected in 11 (7.0%) and H. influenzae in 9 (5.7%) case, multi-pathogen were detected in 120 (76.4%) cases, with the majority were S. pneumoniae combined with H. influenzae and/or combined with other pathogens, S.pnemoniae combined with other pathogens, and H. influenzae combine with other pathogens. The results also show that a significant percentage of viral pathogens were detected but were usually associated with other pathogens and rarely as single agents. The results of the study also evaluated the effectiveness of culture methods and real-time PCR in the detection of microbial pathogens.
Conclusions: This is the first study to apply culture and real-time PCR in the detection of microbial pathogens that cause acute lower respiratory infections out-patients. This result is a very necessary contribution for clinicians to use in the prescription of of antibiotic treatment and also supply the evidence for the guildline of antibiotic therapy.
Key words: Acute lower respiratory infection pathogens
Đặt vấn đề
Nhiễm trùng hô hấp dưới cộng đồng cấp tính là một bệnh lý rất thường gặp. Tùy thuộc vào đánh giá lâm sàng mà các bác sĩ có thể điều trị ngoại trú hay phải cho nhập viện. Đối với các bệnh nhân điều trị ngoại trú thì không nhất thiết phải làm xét nghiệm vi sinh và nếu phải sử dụng kháng sinh để điều trị thì bác sĩ thường cho liệu pháp kháng sinh kinh nghiệm có thể tác động được trên các tác nhân thường gặp được báo cáo qua các nghiên cứu hay qua các tài liệu tham khảo. Tại Việt Nam cho đến hiện nay hầu như có rất ít các nghiên cứu về tác nhân vi sinh gây nhiễm trùng hô hấp cộng đồng điều trị ngoại trú. Do vậy trên các đối tượng bệnh nhân này thì việc cung cấp được dữ liệu về tác nhân vi sinh gây bệnh là rất cần thiết. Tuy nhiên chọn giải pháp xét nghiệm vi sinh nào để có thể phản ảnh được thật sự các tác nhân vi sinh gây bệnh là một vấn đề cần xem xét. Gần đây đã có một báo cáo về phổ vi sinh gây nhiễm trùng hô hấp dưới cộng đồng phải nhập viện[1] mà kết quả real-time PCR cho thấy tác nhân S. pneumoniae chiếm đa số, khác biệt với kết quả nuôi cấy chỉ phát hiện các tác nhân bệnh viện như A. baumannii, P. aeruginosa, E. coli và Enterobacter spp. Điều này cho thấy xét nghiệm vi sinh là thất bại trong phát hiện các tác nhân cộng đồng thường gặp trên các bệnh nhân viêm phổi cộng đồng phải nhập viện, lý do có thể do đa số bệnh nhân đã sử dụng kháng sinh trước. Còn trên các bệnh nhân nhiễm trùng hô hấp dưới có thể điều trị ngoại trú thì đa số là các bệnh nhân mới chưa dùng kháng sinh trước nên xét nghiệm vi sinh có thể hữu dụng hơn chăng. Tuy nhiên xét nghiệm real-time PCR cũng rất cần thiết nhờ khả năng phát hiện các tác nhân vi sinh mà phương pháp nuôi cấy vi sinh không thể phát hiện được như vi khuẩn không điển hình, virus…
Mục tiêu nghiên cứu
Mục tiêu của nghiên cứu này là sử dụng phương pháp vi sinh kinh điển là nuôi cấy kết hợp với phương pháp real-time để phát hiện các tác nhân vi sinh gây nhiễm trùng hô hấp dưới (NTHHD) cộng đồng ở người lớn có thể điều trị ngoại trú. Các mục tiêu cụ thể bao gồm phân tích các tác nhân vi sinh phát hiện được và đánh giá độ nhạy của phương pháp vi sinh và phương pháp real-time PCR trong việc phát hiện được từng tác nhân cụ thể.
Đối tượng nghiên cứu
Đây là một nghiên cứu đa trung tâm với 5 trung tâm tham gia trong đó phòng xét nghiệm công ty Nam Khoa là nơi thực hiện xét nghiệm còn 4 trung tâm còn lại là BV. Phạm Ngọc Thạch (PNT), Phòng khám đa khoa Ngọc Minh (ĐKNM), BV. Đa Khoa Trung Ương Cần Thơ (TWCT), và BV. Nhân Dân Gia Định (NDGĐ) chịu trách nhiệm chọn bệnh nhân đưa vào nghiên cứu và lấy bệnh phẩm gửi đi xét nghiệm. Đối tượng nghiên cứu là các bệnh nhân được lâm sàng chẩn đoán nhiễm trùng hô hấp dưới cấp có thể điều trị ngoại trú với các tiêu chuẩn nhận vào là (1) 16 tuổi trở lên. (2) Được chẩn đoán NKHHD cấp tính có thể điều trị ngoại trú. (3) Không có nguy cơ nhiễm khuẩn kháng thuốc. (4) Có khả năng uống thuốc. (5) Không có tiền sử dị ứng với thuốc nhóm beta-lactam. (6) Đồng ý ký phiếu thỏa thuận tham gia nghiên cứu (consent form). (8) Đồng ý tái khám. Loại trừ khỏi nghiên cứu các bệnh nhân phải nhập viện, bệnh nhân lao, bệnh nhân bị hen, bệnh nhân viêm xoang, bệnh nhân không lấy được đàm hay mẫu đàm không tin cậy. Thời gian nghiên cứu là từ 1/2017 đến cuối tháng 7/2018. Có 5 trường hợp bệnh lý được cho là nhiễm trùng hô hấp dưới cấp, đó là: (i) Nhiễm trùng hô hấp dưới cộng đồng với triệu chứng hô hấp xảy ra cấp tính (trong vòng 21 ngày), ho và kèm theo ít nhất một trong các biểu hiện triệu chứng hô hấp dưới (như khạc đàm, khó thở, khò khè, đau ngực) mà các triệu chứng này không giải thích được cho bệnh nào khác (thí dụ như viêm xoang, hen, lao). (ii) Viêm phế quản cấp, là tình trạng bệnh cấp tính xảy ra trên bệnh nhân không có bệnh phổi mạn tính từ trước. (iii) Viêm phổi là tình trạng bệnh cấp tính, thường khoảng trên 4 ngày, kèm theo triệu chứng của ít nhất một khu vực (focal) phổi mới xuất hiện tổn thương được xác định bằng hình ảnh X quang ngực có hình mờ phổi với tính chất gợi ý mới xuất hiện và không giải thích được cho bất kỳ bệnh nào khác, CRP >20mg/L[2]. (iv) Đợt cấp COPD là sự cố xấu đi của triệu chứng trên nền bệnh đang có, cần phải thay đổi điều trị so với trị liệu cơ bản; Chẩn đoán COPD cần có ≥140 điểm lâm sàng hoặc ≥210 điểm theo thang điểm CT-COPDS[3]; Được xem là một đợt cấp nhiễm khuẩn COPD trong nghiên cứu này gồm lâm sàng: có 3 triệu chứng mới xuất hiện: tăng khó thở, tăng lượng đàm và tăng đàm mủ hoặc có 2 triệu chứng kể trên nhưng một trong đó là tăng đàm mủ[4] và CRP>15mg/L[5]. (v) Đợt cấp dãn phế quản là tình trạng xấu đi của triệu chứng trên bệnh nhân có triệu chứng gợi ý dãn phế quản (ho, đàm, ho máu); Chẩn đoán dãn phế quản dựa trên triệu chứng lâm sàng, X quang ngực (có hình ảnh gián tiếp gợi ý) hoặc tiền sử đã có chẩn đoán dãn phế quản bằng CT ngực có độ phân giải cao; Được xem là một đợt cấp nhiễm khuẩn trong nghiên cứu này gồm các tiêu chuẩn: Lâm sàng là khạc đàm đục, và CRP là >15mg/L. Đánh giá để quyết định không điều trị ngoại trú và không thu nhận nghiên cứu là các bệnh nhân cần nhập viện điều trị khi có tình trạng toàn thân nặng (giảm tri giác, huyết áp <90/60mmHg, nhịp tim >100lần/p, nhịp thở >30lần/p, SpO2 <90% khi thở khí phòng); Có các bệnh đồng mắc nặng (suy tim, suy thận, suy gan); Có nguy cơ nhiễm khuẩn kháng thuốc (có đợt cấp về hô hấp trong vòng 3 tháng, vừa xuất viện trong 30 ngày, nằm tại giường trên 4 tuần, đang sử dụng corticosteroide uống).
Bệnh phẩm và phương pháp nghiên cứu
Bệnh phẩm được khảo sát trong nghiên cứu này là đàm và quệt mũ sau. Đàm được lấy ngay sau khi bệnh nhân được chẩn đoán là nhiễm trùng hô hấp dưới cấp có thể điều trị ngoại trú, có đủ tiêu chuẩn đưa vào nghiên cứu và trước khi cho bệnh nhân dùng kháng sinh. Để lấy đàm, bệnh nhân được yêu cầu súc miệng bằng nước muối sinh lý vô trùng trước khi khạc đàm. Đàm khạc được cho vào lọ vô trùng nắp vặn chặt. Quyệt mũi sau được lấy bằng que tăm bông kẽm và được cho vào mũi đến khi chạm vào thành sau của hốc mũi. Bệnh phẩm sau khi lấy xong được chuyển ngay tới phòng xét nghiệm của công ty Nam Khoa. Đối với mẫu lấy từ BV. Đa Khoa TW Cần Thơ thì ngay sau khi lấy xong mẫu được cho vào thùng xốp có gel đá để chuyển đến phòng xét nghiệm của công ty Nam Khoa ngay trong ngày. Tại phòng xét nghiệm, mẫu đàm được làm một phết nhuộm Gram và quan sát dưới quang trường x100. Mẫu được đánh giá là tin cậy để nuôi cấy và làm xét nghiệm real-time PCR khi có những quang trường có >25 bạch cầu đa nhân trung tính/quang trường và <10 tế bào biểu mô/quang trường. Các mẫu tin cậy được tiến hành nuôi cấy định lượng dựa theo qui trình thường qui mà phòng xét nghiệm đang áp dụng. Sau khi tiến hành nuôi cấy, các mẫu được chuyển đến bộ phận dịch vụ xét nghiệm sinh học phân tử để được tiến hành xét nghiệm real-time PCR phát hiện các tác nhân vi sinh gây bệnh có trong mẫu. Các mẫu quệt mũi sau được làm xét nghiệm real-time PCR chứ không qua nuôi cấy. Qui trình real-time PCR phát hiện các tác nhân vi sinh hiện diện trong các mẫu đàm hay bệnh phẩm có đàm tại phòng thí nghiệm công ty Nam Khoa được tóm tắt như sau: (1) Trước hết mẫu được làm thuần nhất bằng một thể tích dung dịch thuần nhất đàm là PBS có chứa NALC (N-Acetyl L-Cysteine). (2) Sau đó mẫu được tách chiết nucleic acid trên máy tách chiết tự động KingFisher FLEX của hãng Thermo với bộ thuốc thử NKRNADNAprep-MAGBEAD của công ty Nam Khoa, bộ thuốc thử này đã được thẩm định bằng cách so sánh với phương pháp BOOM tách chiết nucleic acid, phương pháp sử dụng Trizol-LS tách chiết RNA và phương pháp tách chiết nucleic acid dùng hệ thống kín MagnaPure của Roche[6]. (3) Các tách chiết nucleic acid từ các mẫu đàm được đưa vào thực hiện real-time PCR sử dụng các mồi và taqman probe đặc hiệu để phát hiện và định lượng các tác nhân vi sinh bao gồm: (i) các vi khuẩn cộng đồng là Streptococcus pneumoniae, Haemophilus influenzae, H. influenzae type b, M. catarrhalis, Streptococci nhóm A, Streptococci nhóm B, và Streptococcus suis; (ii) các vi khuẩn không điển hình là Mycoplasma pneumoniae, Chlamydia pneumoniae, Bordetella pertussis, Bordetella parapertussis, và Legionella pneumophila; (iii) các vi khuẩn bệnh viện là Staphylococcus aureus kháng hay nhạy methicillin, S. epidermidis kháng hay nhạy methicillin, S. aureus có độc tố Pantom-Valentine Leukocydine, Enterococcus faecalis, E. faecium, E. coli, K. pneumoniae, P. aeruginosa, và A. baumannii; các virus là Influenzavirus A, B, C, Parainfluenzavirus 1, 2, 3, Respiratory Syncytial Virus, Human Metapneumovirus, Rhinovirus, và Adenovirus. Các multiplex real-time PCR trên được công ty Nam Khoa chế tạo dựa trên nhiều nghiên cứu đã công bố trước đây[7-9]. Kết quả phát hiện và định lượng các tác nhân vi sinh gây bệnh được trả lời qua số đơn vị phát hiện được (detection unit) và mỗi đơn vị phát hiện được là tương đương 5 copies tác nhân vi sinh dựa theo nghiên cứu được lưu trong hồ sơ nghiên cứu và phát triển của công ty Nam Khoa. Tác nhân vi sinh được xác định là tác nhân gây bệnh khi kết quả real-time PCR cho số định lượng là ≥20.000 DU (tức là ≥100.000 copies). Riêng đối với tác nhân vi khuẩn không điển hình và tác nhân virus vì không có tiêu chuẩn nên trong nghiên cứu này chúng tôi cho là tác nhân gây bệnh nếu số định lượng là ≥1.000 DU (tức là ≥5.000 copies). Ngoài ra, mẫu bệnh phẩm cũng được thực hiện real-time PCR phát hiện M. tuberculosis theo qui trình thường qui tại phòng thí nghiệm của công ty Nam Khoa. Để tiện phân tích, các kết quả real-time PCR và kết quả nuôi cấy được lưu trong hồ sơ exel.
Kết quả nghiên cứu
Trong thời gian từ tháng 1/2017 đến tháng 2/2018 đã có 157 bệnh nhân được đưa vào nghiên cứu với 92 từ BV. PNT, 48 từ phòng khám ĐKNM, 10 từ BV. TWCT, và 7 từ BV. NDGĐ. Kết hợp kết quả nuôi cấy và kết quả real-time PCR (bảng 1) đã xác định được tác nhân vi sinh trong 144 trường hợp chiếm tỷ lệ 91.7%, trong đó phát hiện đơn tác nhân là 24 trường hợp (15.3%) với S. pneumoniae chiếm đa số là 11 (7.0%) và H. influenzae là 9 (5.7%). Đa tác nhân phát hiện được trong 120 trường hợp chiếm tỷ lệ 76.4% trong đó phát hiện cả S. pneumoniae và H. influenzae là 85 trường hợp (54.1%) với 40 (25.5%) không đi kèm các tác nhân khác, và 45 (28.7%) đi kèm các tác nhân khác như virus, tác nhân cộng đồng khác, vi nấm, tác nhân bệnh viện. Trong số đa tác nhân cũng phát hiện sự S. pneumoniae đi kèm các tác nhân khác trong 17 trường hợp (10.8%) và H. influenzae đi kèm các tác nhân khác trong 12 trường hợp (7.6%). Chỉ có 6 trường hợp phát hiện tác nhân gây bệnh không phải là S. pneumoniae hay H. influenzae, chiếm tỷ lệ 3.8%. Kết quả này cho thấy S. pneumoniae và H. influenzae là hai tác nhân chủ yếu phát hiện được với tỷ lệ 72.5% trong đó kết hợp vừa S. pneumoniae với H. influenzae là 54.1%.
Bảng 1: Các tác nhân vi sinh phát hiện được bằng phương pháp real-time PCR và phương pháp nuôi cấy (real-time PCR [+] và/hay nuôi cấy [+])
|
Tác nhân |
KẾT QUẢ |
Tác nhân |
KẾT QUẢ |
||
|
No |
% |
No |
% |
||
|
Đơn tác nhân |
24 |
15.3 |
SP+tác nhân khác |
17 |
10.8 |
|
Rhino |
2 |
1.3 |
SP, CA |
2 |
1.3 |
|
Para3 |
1 |
0.6 |
SP, MC |
1 |
0.6 |
|
HI |
9 |
5.7 |
SP, MP |
1 |
0.6 |
|
SP |
11 |
7.0 |
SP, virus |
7 |
4.5 |
|
PSA |
1 |
0.6 |
SP, Para3 |
1 |
0.6 |
|
Phối hợp SP+HI |
85 |
54.1 |
SP, FluA |
2 |
1.3 |
|
SP, HI |
40 |
25.5 |
SP, FluB |
1 |
0.6 |
|
SP, HI |
40 |
25.5 |
SP, Adeno |
1 |
0.6 |
|
SP, HI, Virus |
14 |
8.9 |
SP, Rhino |
2 |
1.3 |
|
SP, HI, FluA |
2 |
1.3 |
SP, CA, Virus |
1 |
0.6 |
|
SP, HI, FluB |
2 |
1.3 |
SP, MP, FluA |
1 |
0.6 |
|
SP, HI, Rhino |
7 |
4.5 |
SP, fungi |
1 |
0.6 |
|
SP, HI, RSV |
2 |
1.3 |
SP, Asp |
1 |
0.6 |
|
SP, HI, Para3 |
1 |
0.6 |
SP, Fungi, virus |
2 |
1.3 |
|
SP, HI, CA, virus |
13 |
8.3 |
SP, Rhino, Can |
1 |
0.6 |
|
SP, HI, MC |
6 |
3.8 |
SP, Rhino, Afl |
1 |
0.6 |
|
SP, HI, GAS |
1 |
0.6 |
SP, HA, virus |
4 |
2.5 |
|
SP, HI, GBS |
4 |
2.5 |
SP, PSA |
1 |
0.6 |
|
SP, HI, MP |
1 |
0.6 |
SP, Eclo |
1 |
0.6 |
|
SP, HI, MC, Rhino |
1 |
0.6 |
SP, AB, KLP, Eclo |
1 |
0.6 |
|
SP, HI, HA, fungi |
13 |
8.3 |
SP, PSA, Rhino |
1 |
0.6 |
|
SP, HI, SA |
3 |
1.9 |
HI+tác nhân khác |
12 |
7.6 |
|
SP, HI, Eaggl |
2 |
1.3 |
HI, CA |
4 |
2.5 |
|
SP, HI, PSA |
1 |
0.6 |
HI, MC |
4 |
2.5 |
|
SP, HI, KLP |
6 |
3.8 |
HI, virus |
1 |
0.6 |
|
SP, HI, KLP, Can |
1 |
0.6 |
HI, Adeno |
1 |
0.6 |
|
SP, HI, CA, HA, Virus |
5 |
3.2 |
HI, HA, virus |
7 |
4.5 |
|
SP, HI, MC, PSA |
1 |
0.6 |
HI, FluB, KLP |
1 |
0.6 |
|
SP, HI, MC, SA |
1 |
0.6 |
HI, FluB, PSA |
1 |
0.6 |
|
SP, HI, MP, Can |
1 |
0.6 |
HI, PSA, Can |
1 |
0.6 |
|
SP, HI, MP, Eaggl |
1 |
0.6 |
HI, MRSA |
1 |
0.6 |
|
SP, HI, MP, KLP, Rhino |
1 |
0.6 |
HI, KLP |
1 |
0.6 |
|
|
|
|
HI, Eaggl |
2 |
1.3 |
|
Không có SP và HI |
3 |
1.9 |
Không có SP và HI |
3 |
1.9 |
|
MC, Asp |
1 |
0.6 |
KLP, Can |
1 |
0.6 |
|
FluA, Can |
1 |
0.6 |
Eco, Afu, Can |
1 |
0.6 |
|
Eco, FluB |
1 |
0.6 |
Eaero, Can |
1 |
0.6 |
|
Phát hiện được |
144 |
91.7 |
Không phát hiện được |
13 |
8.3 |
HI: H. influenzae, SP: S. pneumoniae, MC: M. catarrhalis, MP: M. pneumoniae, GAS: Streptococcus spp Group A, GBS: Streptococcus spp. Group B, Eco: E. coli, Eclo: E. cloacae, Eaero: E. aerogenes, Eaggl: E. agglomerans, KLP: K. pneumoniae, PSA: P. aeruginosa, AB: A. baumannii, SAU: S. aureus, Afu: A. fumigatus, Afl: A. flavus, Asp: Aspergillus spp., Can: Candida, Rhino: Rhinovirus, Adeno: Adenovirus, FluA: Influenzavirus A, FluB: Influenzavirus B, Para3: Parainfluenzavirus 3, RSV: Respiratory Syncital Virus, CA: Community acquired bacteria, HA: Hospital acquired bacteria
Bảng 2: Các tác nhân vi sinh phát hiện được bằng phương pháp real-time PCR
|
Tác nhân |
KẾT QUẢ |
Tác nhân |
KẾT QUẢ |
||
|
No |
% |
No |
% |
||
|
Đơn tác nhân |
31 |
19.7 |
SP+tác nhân khác |
20 |
12.7 |
|
Fungi |
2 |
1.3 |
SP, CA |
2 |
1.3 |
|
Rhino |
2 |
1.3 |
SP, MC |
1 |
0.6 |
|
Para3 |
1 |
0.6 |
SP, MP |
1 |
0.6 |
|
HI |
9 |
5.7 |
SP, virus |
9 |
5.7 |
|
SP |
16 |
10.2 |
SP, Para3 |
1 |
0.6 |
|
PSA |
1 |
0.6 |
SP, FluA |
2 |
1.3 |
|
Phối hợp SP+HI |
76 |
48.4 |
SP, FluB |
2 |
1.3 |
|
SP, HI |
41 |
26.1 |
SP, Adeno |
1 |
0.6 |
|
SP, HI |
41 |
26.1 |
SP, Rhino |
3 |
1.9 |
|
SP, HI, Virus |
12 |
7.6 |
SP, CA, Virus, fungi |
2 |
1.3 |
|
SP, HI, FluA |
2 |
1.3 |
SP, MP, FluA |
1 |
0.6 |
|
SP, HI, FluB |
1 |
0.6 |
SP, MC, Rhino |
1 |
0.6 |
|
SP, HI, Rhino |
6 |
3.8 |
SP, Fungi, virus |
3 |
1.9 |
|
SP, HI, RSV |
2 |
1.3 |
SP, Asp |
1 |
0.6 |
|
SP, HI, Para3 |
1 |
0.6 |
SP, Rhino, Can |
1 |
0.6 |
|
SP, HI, CA |
13 |
8.3 |
SP, Rhino, Afl |
1 |
0.6 |
|
SP, HI, MC |
6 |
3.8 |
SP, HA, virus |
4 |
2.5 |
|
SP, HI, GAS |
1 |
0.6 |
SP, PSA |
1 |
0.6 |
|
SP, HI, GBS |
4 |
2.5 |
SP, Eclo |
1 |
0.6 |
|
SP, HI, MP |
2 |
1.3 |
SP, AB, KLP, Eclo |
1 |
0.6 |
|
SP, HI, HA, fungi |
8 |
5.1 |
SP, Rhino, PSA |
1 |
0.6 |
|
SP, HI, SA |
3 |
1.9 |
HI+tác nhân khác |
10 |
6.4 |
|
SP, HI, PSA |
2 |
1.3 |
HI, CA, virus |
5 |
3.2 |
|
SP, HI, KLP |
2 |
1.3 |
HI, MC |
4 |
2.5 |
|
SP, HI, KLP, Can |
1 |
0.6 |
HI, Adeno |
1 |
0.6 |
|
SP, HI, CA, HA, Virus |
2 |
1.3 |
HI, HA, fungi, virus |
5 |
3.2 |
|
SP, HI, MC, SA |
1 |
0.6 |
HI, FluB, KLP |
1 |
0.6 |
|
SP, HI, MP, KLP, Rhino |
1 |
0.6 |
HI, FluB, PSA |
1 |
0.6 |
|
Không có SP và HI |
5 |
3.2 |
HI, PSA, Can |
1 |
0.6 |
|
MC, Asp |
1 |
0.6 |
HI, SA |
1 |
0.6 |
|
MP, Can |
1 |
0.6 |
HI, KLP |
1 |
0.6 |
|
FluA, Can |
1 |
0.6 |
|
|
|
|
Eco, FluB |
1 |
0.6 |
Phát hiện được |
142 |
90.4 |
|
Eco, Afu, Can |
1 |
0.6 |
Không phát hiện được |
15 |
9.6 |
HI: H. influenzae, SP: S. pneumoniae, MC: M. catarrhalis, MP: M. pneumoniae, GAS: Streptococcus spp Group A, GBS: Streptococcus spp. Group B, Eco: E. coli, Eclo: E. cloacae, Eaero: E. aerogenes, Eaggl: E. agglomerans, KLP: K. pneumoniae, PSA: P. aeruginosa, AB: A. baumannii, SAU: S. aureus, Afu: A. fumigatus, Afl: A. flavus, Asp: Aspergillus spp., Can: Candida, Rhino: Rhinovirus, Adeno: Adenovirus, FluA: Influenzavirus A, FluB: Influenzavirus B, Para3: Parainfluenzavirus 3, RSV: Respiratory Syncital Virus, CA: Community acquired bacteria, HA: Hospital acquired bacteria
Kết quả real-time PCR đã phát hiện được tác nhân gây bệnh trong 142 trường hợp, chiếm tỷ lệ 90.4%. Như vậy là có 2 trường hợp có tác nhân gây bệnh mà real-time PCR không phát hiện được, đó là hai trường hợp nuôi cấy phát hiện được tác nhân H. influenzae. Kết quả chi tiết được trình bày trong bảng 2. Phân tích cho thấy có 31 (19.7%) trường hợp real-time PCR chỉ phát hiện được đơn tác nhân trong đó chiếm đa số là S. pneumoniae 16 (10.2%) và H. influenzae 9 (5.7%) trường hợp. Có 111 (70.7%) trường hợp phát hiện được đa tác nhân trong đó phát hiện đồng thời S. pneumoniae và H. influenzae 76 (48.4%) trường hợp với 41 (26.1%) trường hợp không kết hợp với các tác nhân khác và 35 (22.3%) kết hợp với các tác nhân khác như virus, tác nhân cộng đồng, tác nhân bệnh viện hay nấm. Có 20 (12.7%) trường hợp S. pneumoniae kết hợp với tác nhân khác và 10 (6.4%) trường hợp H. influenzae kết hợp với tác nhân khác. Chỉ có 5 (3.2%) trường hợp real-time PCR phát hiện đa tác nhân mà không phải là S. pneumoniae hay H. influenzae. Như vậy có thể nói với real-time PCR, H. influenzae và S. pneumoniae là hai tác nhân chủ yếu phát hiện được trên 131 các trường hợp chiếm tỷ lệ đến 83.4%.
Bảng 3 trình bày kết quả tác nhân vi sinh phát hiện được bằng nuôi cấy. Phân tích cho thấy có 118 trường hợp nuôi cấy phát hiện được tác nhân vi sinh gây bệnh, chiếm tỷ lệ 75.2%. Như vậy có 26 trường hợp nuôi cấy không phát hiện được tác nhân gây bệnh. Các tác nhân gây bệnh mà nuôi cấy không thể phát hiện được là virus, vi khuẩn không điển hình như M. pneumoniae. Ngoài ra S. pneumoniae là tác nhân mà phương pháp nuôi cấy phát hiện khá thấp và đây cũng là lý do đã làm cho tỷ lệ phát hiện tác nhân vi sinh của nuôi cấy chỉ đạt 75.2% so với kết quả chung là 91.7% và kết quả real-time PCR là 90.4%. Kết quả nuôi cấy cho thấy có 69 (43.9%) phát hiện được đơn tác nhân với H. influenzae chiếm đa số 51 (32.5%) rồi đến S. pneumoniae 10 (6.4%). Có 48 (30.6%) trường hợp nuôi cấy phát hiện được hai tác nhân với 29 (19.5%) là kết hợp S. pneumoniae với H. influenzae và 19 (12.1%) là kết hợp H. influenzae với tác nhân khác. Chỉ có 1 trường hợp là 3 tác nhân là E. coli phối hợp với A. fumigatus và Candida.
Bảng 3: Các tác nhân vi sinh phát hiện được bằng phương pháp nuôi cấy
|
Tác nhân |
KẾT QUẢ |
Tác nhân |
KẾT QUẢ |
||
|
No |
% |
No |
% |
||
|
Đơn tác nhân |
69 |
43.9 |
HI, CA |
7 |
4.5 |
|
HI |
51 |
32.5 |
HI, MC |
6 |
3.8 |
|
SP |
10 |
6.4 |
HI, GAS |
1 |
0.6 |
|
MC |
2 |
1.3 |
HI, HA |
12 |
7.6 |
|
Eco |
1 |
0.6 |
HI, PSA |
1 |
0.6 |
|
Eaggl |
1 |
0.6 |
HI, KLP |
6 |
3.8 |
|
Eaero |
1 |
0.6 |
HI, Eaero |
1 |
0.6 |
|
KLP |
3 |
1.9 |
HI, Eaggl |
4 |
2.5 |
|
SP, HI |
29 |
18.5 |
HA, fungi |
1 |
0.6 |
|
SP, HI |
29 |
18.5 |
Eco, Afu, Can |
1 |
0.6 |
|
Dương |
118 |
75.2 |
Âm |
39 |
24.8 |
HI: H. influenzae, SP: S. pneumoniae, MC: M. catarrhalis, GAS: Streptococcus spp Group A, Eco: E. coli, Eaero: E. aerogenes, Eaggl: E. agglomerans, KLP: K. pneumoniae, PSA: P. aeruginosa, Afu: A. fumigatus, Can: Candida, CA: Community acquired bacteria, HA: Hospital acquired bacteria
Bảng 4 trình bày số lượng và tỷ lệ các tác nhân vi sinh phát hiện được bằng phương pháp real-time PCR và bằng phương pháp nuôi cấy. Biểu đồ 1 so sánh tỷ lệ phát hiện được các tác nhân vi sinh bằng cả hai phương pháp. Phân tích thống kê các tác nhân mà cả hai phương pháp real-time PCR và phương pháp nuôi cấy đều phát hiện được thì chúng ta thấy tỷ lệ S. pneumoniae được phương pháp real-time PCR phát hiện được là 71.3%, cao hơn tỷ lệ phát hiện được bằng phương pháp nuôi cấy 25.5% và sự khác biệt này là rất có ý nghĩa thống kê với P<0.00001. Tỷ lệ phát hiện H. influenzae bằng phương pháp real-time PCR là 60.5% thấp hơn phương pháp nuôi cấy là 63.1%, tuy nhiên sự khác biệt này là không có ý nghĩa thống kê với P>0.05. Đối với M. catarrhalis và K. pneumoniae mặc dù tỷ lệ phát hiện được bằng real-time PCR là 8.9% và 4.5% so với nuôi cấy là 5.1% và 5.7% nhưng sự khác biệt là không có ý nghĩa với P>0.05. Đối với P. aeruginosa thì real-time PCR có tỷ lệ phát hiện được là 4.5% so với nuôi cấy là 0.6% nhưng sự khác biệt này chỉ có ý nghĩa thấp với P<0.035. Đối với vi nấm thì real-time PCR có tỷ lệ phát hiện là 7% so với nuôi cấy chỉ 0.6% và sự khác biệt rất có ý nghĩa với P<0.0038.
Bảng 4: Số lượng và tỷ lệ các tác nhân vi sinh phát hiện được bằng phương pháp real-time PCR và bằng phương pháp nuôi cấy vi sinh
|
Tác nhân |
PCR |
Cấy |
Tác nhân |
PCR |
Cấy |
||||
|
N |
% |
N |
% |
N |
% |
N |
% |
||
|
SP |
112 |
71.3 |
40 |
25.5 |
SAU |
5 |
3.2 |
0 |
0 |
|
HI |
95 |
60.5 |
99 |
63.1 |
AB |
1 |
0.6 |
0 |
0 |
|
MC |
14 |
8.9 |
8 |
5.1 |
PSA |
7 |
4.5 |
1 |
0.6 |
|
GAS |
1 |
0.6 |
1 |
0.6 |
Fungi |
11 |
7 |
1 |
0.6 |
|
GBS |
4 |
2.5 |
0 |
0 |
Adeno |
2 |
1.3 |
0 |
0 |
|
MP |
6 |
3.8 |
0 |
0 |
Rhino |
16 |
10.2 |
0 |
0 |
|
Eco |
2 |
1.3 |
2 |
1.3 |
FluA |
6 |
3.8 |
0 |
0 |
|
Eaero |
0 |
0 |
1 |
0.6 |
FluB |
6 |
3.8 |
0 |
0 |
|
Eclo |
2 |
1.3 |
0 |
0 |
Para3 |
3 |
1.9 |
0 |
0 |
|
Eaggl |
0 |
0 |
4 |
2.5 |
RSV |
1 |
0.6 |
0 |
0 |
|
KLP |
7 |
4.5 |
9 |
5.7 |
Tổng |
157 |
|
157 |
|
HI: H. influenzae, SP: S. pneumoniae, MC: M. catarrhalis, MP: M. pneumoniae, GAS: Streptococcus spp Group A, GBS: Streptococcus spp. Group B, Eco: E. coli, Eclo: E. cloacae, Eaero: E. aerogenes, Eaggl: E. agglomerans, KLP: K. pneumoniae, PSA: P. aeruginosa, AB: A. baumannii, SAU: S. aureus, Rhino: Rhinovirus, Adeno: Adenovirus, FluA: Influenzavirus A, FluB: Influenzavirus B, Para3: Parainfluenzavirus 3, RSV: Respiratory Syncital Virus
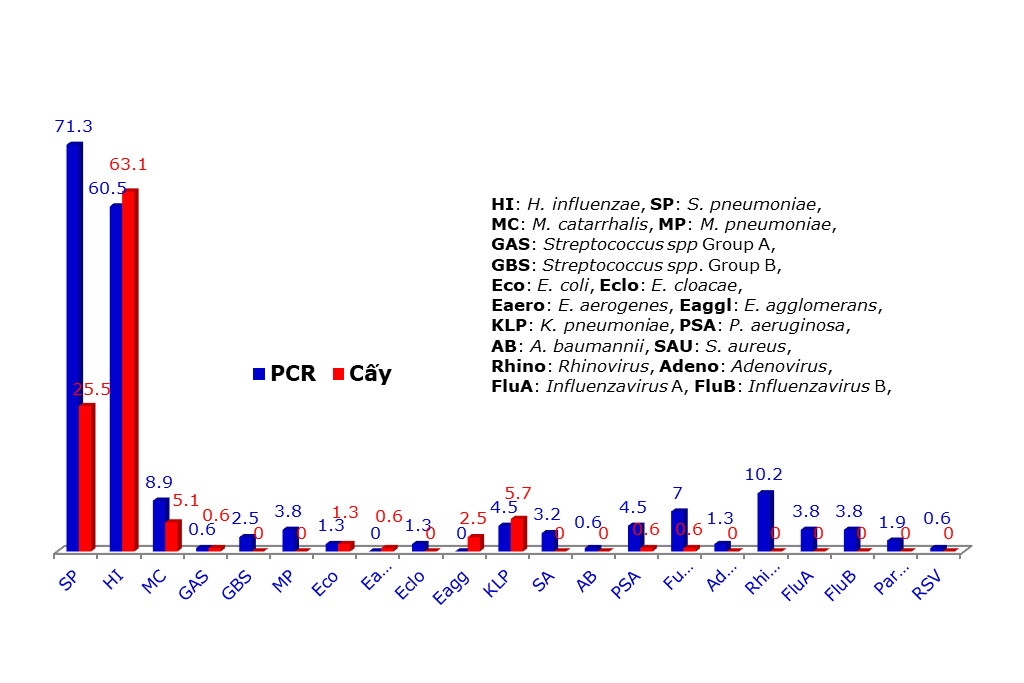
Biểu đồ 1: So sánh tỷ lệ các tác nhân vi sinh phát hiện được bằng phương pháp real-time PCR và bằng phương pháp nuôi cấy
Bảng 5: Độ nhạy của phương pháp real-time PCR và phương pháp nuôi cấy trong phát hiện các tác nhân vi sinh
|
Tác nhân |
PCR |
Cấy |
Kết hợp |
Tác nhân |
PCR |
Cấy |
Kết hợp |
||||
|
N |
Se % |
N |
Se % |
N |
Se % |
N |
Se % |
||||
|
SP |
112 |
99.1 |
40 |
35.4 |
113 |
Eaero |
0 |
0 |
1 |
100 |
1 |
|
HI |
95 |
89.6 |
99 |
93.4 |
106 |
Eagg |
0 |
0 |
4 |
100 |
4 |
|
MC |
14 |
93.3 |
8 |
53.3 |
15 |
GBS |
4 |
100 |
0 |
0 |
4 |
|
GAS |
1 |
100 |
1 |
100 |
1 |
MP |
6 |
100 |
0 |
0 |
6 |
|
Eco |
2 |
100 |
2 |
100 |
2 |
Eclo |
2 |
100 |
0 |
0 |
2 |
|
KLP |
7 |
58.3 |
9 |
75 |
12 |
SAU |
5 |
100 |
0 |
0 |
5 |
|
PSA |
7 |
100 |
1 |
14.3 |
7 |
AB |
1 |
100 |
0 |
0 |
1 |
|
Fungi |
11 |
100 |
1 |
9.1 |
11 |
Adeno |
2 |
100 |
0 |
0 |
2 |
|
HI: H. influenzae, SP: S. pneumoniae, MC: M. catarrhalis, MP: M. pneumoniae, GAS: Streptococcus spp Group A, GBS: Streptococcus spp. Group B, Eco: E. coli, Eclo: E. cloacae, Eaero: E. aerogenes, Eaggl: E. agglomerans, KLP: K. pneumoniae, PSA: P. aeruginosa, AB: A. baumannii, SAU: S. aureus, Rhino: Rhinovirus, Adeno: Adenovirus, FluA: Influenzavirus A, FluB: Influenzavirus B, Para3: Parainfluenzavirus 3, RSV: Respiratory Syncital Virus |
Rhino |
16 |
100 |
0 |
0 |
16 |
|||||
|
FluA |
6 |
100 |
0 |
0 |
6 |
||||||
|
FluB |
6 |
100 |
0 |
0 |
6 |
||||||
|
Para3 |
3 |
100 |
0 |
0 |
3 |
||||||
|
RSV |
1 |
100 |
0 |
0 |
1 |
Bảng 5 trình bày độ nhạy của phương pháp real-time PCR và phương pháp nuôi cấy trong phát hiện các tác nhân vi sinh gây bệnh. Độ nhạy của một phương pháp phát hiện một tác nhân vi sinh A được tính là tỷ lệ % phát hiện được tác nhân vi sinh A bằng phương pháp đó trong tổng số tác nhân A được phát hiện khi kết hợp cả hai phương pháp. Có hai tác nhân là E. aerogenes và E. agglomerans chỉ được phát hiện bằng phương pháp nuôi cấy mà phương pháp real-time PCR không phát hiện được, lý do là vì không có mồi và probe đặc hiệu cho hai tác nhân này trong bộ thuốc thử real-time PCR được sử dụng. Phương pháp nuôi cấy không thể phát hiện được các tác nhân virus như Adenovirus, Rhinovirus, Influenzavirus A, Influenzavirus B, RSV, và Parainflunezavirus 3; cũng như tác nhân vi khuẩn không điển hình M. pneumoniae vì không có phương tiện nuôi cấy thường qui. Tuy nhiên cũng có những tác nhân vi khuẩn có thể nuôi cấy phân lập thường qui như tác nhân S. aureus, A. baumannii, Streptococcus group B, và E. cloacae mặc dù được phát hiện bằng real-time PCR nhưng trong nuôi cấy vẫn không phát hiện được, có lẽ do bị bỏ qua khi phân tích mẫu cấy hay do độ nhạy của phương pháp cấy cho các tác nhân này chưa đạt. Phân tích về độ nhạy thì chúng ta thấy trong phát hiện tác nhân H. influenzae, cả hai phương pháp real-time PCR và phương pháp nuôi cấy đều đạt độ nhạy cao, tuy nhiên đối với S. pneumoniae thì phương pháp nuôi cấy có độ nhạy thấp hơn real-time PCR rất nhiều, 35.4% so với 99.1%. Nguyên nhân có lẽ trong phân tích kết quả nuôi cấy trên hộp thạch phân lập, khúm S. pneumoniae đã bị bỏ qua vì không cho hình ảnh tiêu biểu hay do vi khuẩn bị chết nhanh trong mẫu thử trước khi kịp tiến hành nuôi cấy. Độ nhạy của real-time PCR trong phát hiện tác nhân P. aeruginosa và vi nấm cũng cao hơn nuôi cấy, 100% so với 14.3% và 9.1%. Độ nhạy trong phát hiện M. catarrhalis của real-time PCR là 93.3% cao hơn phương pháp nuôi cấy là 53.3%. Có lẽ nguyên do là các khúm vi khuẩn đã bị bỏ qua khi phân tích kết quả cấy. Đối với K. pneumoniae, độ nhạy của phương pháp nuôi cấy là 75% cao hơn real-time PCR là 53.8% do có 2 trường hợp nuôi cấy được tác nhân K. pneumoniae mà real-time PCR lại không phát hiện được mặc dù các mồi và probe thiết kế là rất đặc hiệu cho K. pneumoniae, điều này có thể là do mồi và probe chưa đủ bao phủ được tất cả các dòng K. pneumoniae hay vì một lý do nào đó đã bị cạnh tranh bởi các DNA khác hiện diện trong mẫu thử được tách chiết DNA. Đối với hai tác nhân Streptococcus group A và E. coli thì độ nhạy của real-time PCR và nuôi cấy là giống nhau, có nghĩa là cả hai phương pháp đều phát hiện được hai tác nhân này, tuy nhiên do số lượng quá ít nên kết luận này chỉ có tính tương đối.
Bàn luận
Xét nghiệm vi sinh mẫu đàm để xác định được tác nhân vi sinh gây nhiễm trùng hô hấp dưới là không phải dễ dàng vì các tác nhân phát hiện được cũng có thể là tác nhân hiện diện trong vùng hầu họng. Chính vì vậy việc đánh giá mẫu đàm để xem có tin cậy hay không bằng quan sát đại thể và quan sát vi thể phết nhuộm Gram ở quang trường 100X là bắt buộc phải thực hiện. Cho dù mẫu đàm có được đánh giá là tin cậy nhưng không phải tác nhân vi sinh nào phát hiện được trong mẫu cũng đều được cho là tác nhân vi sinh gây bệnh mà phải dựa vào kết quả định lượng hay bán định lượng. Kết quả định lượng phải đạt tối thiểu 105 tế bào vi khuẩn phân lập được trong 1ml mẫu đàm hay kết quả bán định lượng vi khuẩn phải hiện diện trên đường cấy thứ 3 của hộp thạch phân lập thì vi khuẩn phân lập được mới được xem là tác ngân gây bệnh. Phương pháp real-time PCR ngoài kết quả phát hiện được tác nhân vi sinh gây bệnh còn cho được kết quả định lượng là số lượng copy bộ gen tác nhân vi sinh cho 1ml đàm nên real-time PCR cũng có thể được xem như cấy định lượng nhưng có nhiều ưu điểm hơn cấy định lượng như: (1) Phát hiện được các tác nhân vi sinh không thể nuôi cấy được thường qui như virus, vi khuẩn không điển hình; (2) Độ nhạy cao nhờ giới hạn phát hiện rất thấp, có thể đến 1 copy trong một thể tích mẫu thử cho vào phản ứng nhờ bản chất là khuếch đại gen rồi mới phát hiện[10-12]; (3) Vượt qua được các hạn chế của phương pháp nuôi cấy như đòi hỏi điều kiện bảo quản và chuyên chở chặt chẽ để vi khuẩn phải còn sống cho đến khi nuôi cấy, còn real-time PCR thì chỉ cần bảo quản lạnh để tác nhân vi sinh trong mẫu không bị xáo trộn cũng như nucleic acid của chúng không bị phá hủy cho đến khi xét nghiệm. Với các lợi điểm như vậy nên gần đây, ngày càng có nhiều báo cáo cho thấy real-time PCR là giải pháp nhạy cảm và đặc hiệu nhất trong phát hiện các tác nhân vi sinh gây viêm phổi hay nhiễm trùng hô hấp dưới[7-9,13,14]. Chính vì những lý do như vậy nên trong nghiên cứu này ngoài nuôi cấy, phương pháp real-time PCR cũng được sử dụng để phát hiện các tác nhân vi sinh gây bệnh trong mẫu thử là đàm và quệt mũi sau trong đó quệt mũi sau như là phương pháp bổ sung cho phát hiện tác nhân virus.
Đối với các bác sĩ điều trị thì việc quyết định kháng sinh trong điều trị nhiễm trùng hô hấp dưới cấp tính cộng đồng mà không cần phải nhập viện là phải sử dụng kháng sinh hướng đến các tác nhân vi khuẩn được ghi nhận là thường gặp nhất. Hội Lao và Bệnh Phổi Việt Nam trong hướng dẫn điều trị các bệnh nhiễm trùng hô hấp dưới không phải do lao đã đưa ra khuyến cáo sử dụng kháng sinh tác động trên các vi khuẩn S. pneumoniae, H. influenzae, M. catrarrhalis, các Streptococcus tiêu huyết beta, các vi khuẩn không điển hình như M. pneumoniae, C. pneumoniae và L. pneumophila. Tuy nhiên cho đến bây giờ vẫn chưa có một dữ liệu nào trong nước đủ tin cậy để nói được trong các tác nhân trên thì tác nhân nào là chủ yếu. Vào năm 2009 đã có một công trình nghiên cứu của Takahashi K. và các cộng sự thực hiện ở Khánh Hòa sử dụng phương pháp PCR để phát hiện các tác nhân vi sinh gây viêm phổi cộng đồng phải nhập viện, tuy nhiên công trình này thực hiện trong dịch cúm 2009 nên khó có thể phản ánh phổ vi sinh thật sự gây CAP[15]. Chúng tôi cũng đã thực hiện những công trình nghiên cứu chứng minh hiệu quả của kỹ thuật real-time PCR trong phát hiện các tác nhân vi sinh gây viêm phổi cộng đồng trên các bệnh nhân người lớn và trẻ em phải nhập viện[16-18] với kết quả cho thấy tác nhân chủ yếu gây bệnh là S. pneumoniae, ngoài ra H. influenzae và M. catarrhalis cũng chiếm tỷ lệ đáng kể; tác nhân vi khuẩn không điển hình M. pneumoniae cũng có vai trò rất quan trọng, có thể là tác nhân gây bệnh chủ yếu và cũng có thể có vai trò phối hợp, đặc biệt trong viêm phổi ở trẻ em. Năm 2016 chúng tôi đã thực hiện một công trình nghiên cứu đa trung tâm sử dụng phương pháp nuôi cấy thường qui tại các bệnh viện tham gia và phương pháp real-time PCR tại phòng thí nghiệm của công ty Nam Khoa để phát hiện các tác nhân vi sinh gây nhiễm trùng hô hấp dưới cộng đồng phải nhập viện[1]. Với phương pháp real-time PCR, kết quả nghiên cứu cho thấy tác nhân S. pneumoniae là chủ yếu, kế đó là H. influenzae; tuy nhiên kết quả nuôi cấy là hoàn toàn thất bại trong phát hiện S. pneumoniae còn đối với tác nhân H. influenzae thì tỷ lệ phát hiện được rất thấp, trong khi đó chỉ phát hiện được các tác nhân vi khuẩn bệnh viện như K. pneumoniae, E. coli, P. aeruginosa và tác nhân A. baumannii với tỷ lệ tương đương phương pháp real-time PCR. Nghiên cứu này đã chỉ ra rằng trên các bệnh nhân nhiễm trùng hô hấp dưới cộng đồng phải nhập viện mặc dù kết quả nuôi cấy chỉ phân lập được các tác nhân vi khuẩn bệnh viện nhưng thật ra tác nhân chủ yếu vẫn là S. pneumoniae và H. influenzae. Ngoài ra kết quả nghiên cứu cũng cho thấy giải pháp real-time PCR rất là cần thiết trong xét nghiệm vi sinh nhiễm trùng hô hấp dưới phải nhập viện vì nếu chỉ dựa vào kết quả cấy thì việc lạm dụng các kháng sinh mạnh hướng đến các tác nhân vi khuẩn bệnh viện là sẽ không tránh khỏi.
Đối với các nhiễm trùng hô hấp dưới cấp cộng đồng mà không cần nhập viện thì hiện nay khó có thể tìm được các dữ liệu nghiên cứu về tác nhân vì chỉ định xét nghiệm vi sinh là không cần thiết. Như vậy dữ liệu vi sinh gây bệnh trên các đối tượng này chỉ có thể có được trên các nghiên cứu tiến cứu mà thôi, và đây chính là một nghiên cứu như vậy. Kết quả sơ bộ của nghiên cứu này đã cho thấy nuôi cấy vẫn có giá trị vì tỷ lệ phát hiện được tác nhân vi khuẩn gây bệnh đạt được đến 75.2% và vi khuẩn phát hiện được cũng chủ yếu là các vi khuẩn cộng đồng kinh điển bao gồm H. influenzae 63.1%, kế đó là S. pneumoniae 25.5%, K. pneumoniae và M. catarrhalis được ghi nhận là tác nhân thứ ba với tỷ lệ là 5.7% và 5.1%. Các tác nhân vi khuẩn bệnh viện cũng được ghi nhận nhưng tỷ lệ khá thấp. Như vậy thì khác với đối tượng nhiễm trùng hô hấp dưới cấp tính phải nhập viện khi mà xét nghiệm vi sinh không thể phân lập được hay chỉ phân lập được ở một tỷ lệ rất thấp các vi khuẩn cộng đồng và sự khác biệt này có lẽ là do bệnh nhân trước khi vào bệnh viện đã sử dụng kháng sinh trước cũng như có các yếu tố làm tăng nặng bệnh cảnh nhiễm trùng trong đó có nhiễm các vi khuẩn bệnh viện. Kết quả real-time PCR trong nghiên cứu này đã thực sự làm phong phú hơn về tác nhân vi sinh gây bệnh phát hiện được nhờ phát hiện được một tỷ lệ đến 21.7% các virus trong đó chiếm đa số là Rhinovirus 10.2% rồi influenzavirus A, B và parainfluenzavirus 3 chiếm đến 9.6%; và vi khuẩn không điển hình M. pneumoniae chiếm 3.8%. Kết quả real-time PCR cũng đã làm thay đổi tỷ lệ vi khuẩn cộng đồng phát hiện được với kết quả tỷ lệ phát hiện S. pneumoniae lên đến 71.3% (trong khi nuôi cấy chỉ 25.5%). Sự kết hợp của hai phương pháp nuôi cấy và real-time PCR đã thật sự cho chúng ta một bức tranh toàn diện và phong phú về tác nhân vi sinh gây nhiễm trùng hô hấp dưới cấp cộng đồng không phải nhập viện như đã trình bày trong phần kết quả.
Kết luận
Không dễ gì để có được dữ liệu về tác nhân vi sinh gây nhiễm trùng hô hấp dưới cấp tính cộng đồng không phải nhập viện vì đây là những đối tượng không có chỉ định làm xét nghiệm vi sinh. Do vậy mà các hướng dẫn sử dụng kháng sinh điều trị bước đầu trên các đối tượng bệnh nhân này cũng chỉ dựa vào các thông tin về tác nhân vi sinh phổ biến được ghi nhận trên các tài liệu giáo khoa hay các nghiên cứu nước ngoài. Đây là một nghiên cứu đầu tiên được thực hiện trong nước trên đối tượng người lớn được lâm sàng chẩn đoán nhiễm trùng hô hấp dưới cấp tính chỉ cần điều trị ngoại trú. Kết quả nghiên cứu tuy là bước đầu trên 157 bệnh nhân nhưng cũng đã cho một dữ liệu khá phong phú về tác nhân vi sinh gây bệnh, đó là: (1) xét về phổ tác nhân vi sinh gây bệnh thì phổ biến nhất là S. pneumoniae, kế đó là H. influenzae rồi đến M. catarrhalis; (2) Tác nhân virus được phát hiện với tỷ lệ khá cao mà phổ biến là Rhinovirus với tỷ lệ còn cao hơn M. catarrhalis; (3) Tác nhân vi khuẩn không điển hình được phát hiện là M. pneumoniae nhưng ở tỷ lệ khá thấp khác với kết quả mà chúng tôi đã nghiên cứu trên đối tượng là trẻ con tỷ lệ M. pneumoniae được phát hiện khá cao[17,18]. (4) Các tác nhân vi khuẩn bệnh viện chiếm tỷ lệ khá thấp và đây cũng chính là yếu tố giúp cho các đối tượng bệnh nhân được lâm sàng chỉ định điều trị ngoại trú, khác với nghiên cứu trước đây trên các bệnh nhân nhiễm trùng hô hấp dưới phải nhập viện trong đó có một tỷ lệ đáng kể phát hiện được tác nhân vi khuẩn bệnh viện; (4) Đa số các trường hợp là có sự phối hợp nhiều tác nhân, trong đó cao nhất là phối hợp S. pneumoniae với H. influenzae hoặc đơn thuần hoặc phối hợp với các tác nhân khác, kế đó là phối hợp S. pneumoniae với các tác nhân khác, rồi đến phối hợp H. influenzae với các tác nhân khác, chỉ có một tỷ lệ nhỏ phối hợp các tác nhân vi khẩn bệnh viện với các tác nhân khác. Chúng tôi hy vọng rằng các dữ liệu của nghiên cứu này sẽ là một đóng góp cho các nhà điều trị xây dựng phát đồ điều trị kháng sinh hiệu quả trên các đối tượng người lớn được chẩn doán nhiễm trùng hô hấp dưới điều trị ngoại trú.
Tài liệu tham khảo
1. Vân P.H. và CS. (2017). Tác nhân vi sinh gây viêm phổi cộng đồng phải nhập viện – Kết quả nghiên cứu REAL 2016-2017. Hội Hô Hấp TP. HCM
2. Falk G and Fahey T. (2009). C-reactive protein and community-acquired pneumonia in ambulatory care: systematic review of diagnostic accuracy studies. Family Practice; 26: 10–21
3. Thành N.V. và CS. (2012). Xây dựng mô hình hệ thống quản lý và điều trị hiệu quả COPD và Hen phế quản trong bệnh viện và ở cộng đồng. NXB Y Học 2012, 57-69
4. Woodhead M. et al. (2011). Guidelines for the management of adult lower respiratory tract infections – full version. Clin Microbiol Infect.; 17(Suppl. 6): E1–E59
5. Peng C et al. (2013). C-reactive protein levels predict bacterial exacerbation in patients with chronic obstructive pulmonary disease. Am J Med Sci.; 345(3):190-4.
6. Van P.H. et al. (2015). The solution for the low-income countries to establish the automatic extraction of the nucleic acid from the clinical samples. Asean Congress on Medical Biotechnology and Molecular Biosciences 2015. October 8th – 9th, 2015 at Arnoma Grand Hotel, Bangkok, Thailand. Pp37
7. Gadsby N. J. et al. (2015). Development of two real-time multiplex PCR assays for the detection and quantification of eight key bacterial pathogens in lower respiratory tract infections. Clin Microbiol Infect. 21:788.e1-788.e13
8. Jan J. O. et al. (2015). Impact of Rapid Detection of Viral and Atypical Bacterial Pathogens by Real-Time Polymerase Chain Reaction for Patients with Lower Respiratory Tract Infection. Clinical Infectious Diseases. 41:1438–44.
9. Alicia Edin et al. (2015). Development and Laboratory Evaluation of a Real-Time PCR Assay for Detecting Viruses and Bacteria of Relevance for Community-Acquired Pneumonia. The Journal of Moleculat Diagnostics. 17(3):315-324
10. Vân P.H. (2009). PCR và real-time PCR: Các vấn đề cơ bản và các ứng dụng thường gặp. Nhà xuất bản y học. tr3-tr33
11. Naomi J. Gadsby et al. (2016). Comprehensive Molecular Testing in CAP. CID. 62(1 April):817-823
12. Margret Schuller et al. (2010). PCR for Clinical Microbiology. Springer publisher. Pp11-48
13. Chae Lim Jung et al. (2010). Clinical Evaluation of the Multiplex PCR Assay for the Detection of Bacterial Pathogens in Respiratory Specimens from Patients with Pneumonia. Korean J Clin Microbiol 13(1): 40-45.
14. Tie-Gang Zhang et al. (2015). Detection of respiratory viral and bacterial pathogens causing pediatric community-acquired pneumonia in Beijing using real-time PCR. Chronic Diseases and Translational Medicine.1:110-16
15. Takahashi K., Yoshida L. M. et al. (2013). The incidence and aetiology of hospitalized community-acquired pneumonia among Vietnamese adults: a prospective surveillance in Central Vietnam. BMC Infectious Diseases. 13:296
16. Vy T.T.T. (2014). Xác định tỷ lệ các tác nhân vi khuẩn không điển hình gây viêm phổi nhập viện tại Bệnh Viện Nguyễn Tri Phương trong thời gian từ tháng 11/2013 đến 06/2014. Luận Văn Thạc Sĩ Y Học.
17. Vân B.L.H.B. (2015). Tác nhân gây viêm phổi cộng đồng không đáp ứng với điều trị kháng sinh ban đầu ở trẻ dưới 5 tuổi tại Khoa Nội Tổng Quát 2 Bệnh Viện Nhi Đồng 1. Luận Văn Thạc Sĩ Y Học chuyên ngảnh vi sinh. tr52-tr57
18. Khải T.Q. (2016). Đặc điểm bệnh viêm phổi Thùy ở trẻ em tại khoa Nội Tổng Quát 2 bệnh viện Nhi Đồng 1. Luận văn tốt nghiệp thạc sĩ chuyên ngành nhi khoa. Tr60-tr67
[1]Phòng xét nghiệm công ty Nam Khoa, 2Hội Lao và Bệnh Phổi Việt Nam, 3Khoa Hô Hấp BV. Chợ Rẫy, 4Khoa Hô Hấp BV. Phạm Ngọc Thạch, 5Khoa Hô Hấp BV. Nhân Dân Gia Định, 6Khoa Hô Hấp BV. Đa Khoa Trung Ương Cần Thơ, 7Đại Học Phan Châu Trinh, 8Đại Học Y Khoa Phạm Ngọc Thạch, 9Đại Học Sydney, *Chịu trách nhiệm chính