TÓM TẮT
Nitric oxide (NO) vừa là một chất khí vừa là một phân tử rất phổ biến trong tất cả các loài động vật, với khả năng dẫn truyền thông tin giữa các tế bào của gần hết các bộ phận trên cơ thể con người. Vì sự tổng hợp NO tăng lên khi có đáp ứng viêm của cơ thể nên NO có thể sử dụng như là chất đánh dấu thay thế cho viêm cấp và / hoặc mạn tính. Việc đo lường phân suất nồng độ NO trong khí thở ra (FeNO) nhằm phát hiện viêm đường dẫn khí, từ đó cải thiện chẩn đoán hen bằng cách định rõ đặc điểm bệnh nhân hen có viêm phế quản tăng bạch cầu ái toan. Sử dụng FeNO cải thiện kiểm soát bệnh hen bằng cách điều trị trúng đích.
Phương pháp đo FeNO đang được xem như là một phương tiện đánh giá chức năng hô hấp mới, dễ sử dụng, và có thể đo lặp lại nhiều lần. Việc đo NO trong khí thở ra là phép đo duy nhất cho phép (1) phát hiện, (2) định lượng và (3) theo dõi sự thay đổi các quá trình viêm trong suốt tiến trình của nhiều bệnh lý hô hấp khác nhau, trong đó bao gồm bệnh hen thể nhạy corticoid.
GIỚI THIỆU
Nitric oxide (NO) là chất khí sinh học có vai trò sinh lý học lâu đời hơn cả khí oxygen [1]. Với đặc tính hóa học này, NO – vừa được sử dụng ở dạng hít vào và vừa có thể phát hiện trong khí thở ra ở bệnh nhân [2]. Hai mươi năm sau bài viết nghiên cứu đầu tiên của Gustafsson và cộng sự [3], việc đo nồng độ khí NO trong khí thở ra (FeNO) đã trở thành một phương pháp định lượng không xâm lấn tình trạng viêm đường hô hấp đang được sử dụng ngày càng rộng rãi tại các bệnh viện lớn [4, 5]. Trong khoảng 20 năm qua, có gần 3600 bài báo về khí NO được đăng tải trên Pubmed [6], trong đó có hơn 2500 bài báo liên quan đến đo NO trong khí thở ra ở bệnh hen [7]. Hai hiệp hội hàng đầu thế giới về hô hấp là Hội lồng ngực Hoa Kỳ (American Thoracic Society – ATS) và Hội Hô hấp Châu Âu (European Respiratory Society – ESR) bao gồm các bác sĩ hô hấp, các nhà dị ứng học, nhà sinh lý học và bác sĩ hô hấp nhi, đã ấn bản những khuyến cáo đầu tiên liên quan đến NO từ năm 1997. Từ đó, các khuyến cáo đã liên tục được cập nhật, cho thấy tiềm năng rất lớn của phương pháp đo này trong các bệnh lý hô hấp.
So với các phương pháp thăm dò chức năng hô hấp hiện tại, thì phép đo NO trong khí thở ra có nhiều ưu điểm rõ rệt hơn, nhưng không vì thế mà có khuynh hướng thay thế chúng. Không xâm lấn cho bệnh nhân, dễ thực hiện đối với các bác sĩ, y tá hoặc kỹ thuật viên đo chức năng hô hấp, phép đo NO trong khí thở ra là phép đo duy nhất có ưu điểm không xâm lấn và có thể lặp lại nhiều lần để phát hiện viêm trong đường dẫn khí. Phép đo này hỗ trợ chẩn đoán hen và cho phép dễ dàng xác định kiểu hình hen tốt hơn, đặc biệt là liên quan với khả năng nhạy cảm với điều trị corticosteroid. Do đó, hen là bệnh lý được quan tâm đến nhiều nhất khi nói đến phép đo NO vì nhờ tần suất bệnh hen, cơ chế sinh lý bệnh chủ yếu là viêm mạn tính đường dẫn khí và được điều trị chủ yếu bằng corticoid (hít hoặc uống). Các bệnh lý khác cũng có liên quan và làm thay đổi sự sản xuất NO ở phổi, nhưng tần suất bệnh hiếm gặp hơn, như: bệnh xơ nang [11], rối loạn hoạt động nhung mao [12] và bệnh phổi mô kẽ gây ra do xơ cứng bì toàn thân [13, 14]. Các nghiên cứu đánh giá phép đo NO trong khí thở ra trong các bệnh lý này, mặc dù đang gia tăng về số lượng, sẽ không được phân tích trong bài viết này mà bài viết chủ yếu tập trung vào vai trò của phép đo NO trong khí thở ra ở bệnh nhân hen.
SINH HỌC CỦA NO
Sinh tổng hợp của gốc NO từ L-arginine và phân tử oxygen, được điều khiển bởi họ enzyme tổng hợp NO (NO synthase, NOS), bao gồm 3 dạng đồng phân (NOS-1, NOS-2 và NOS-3) khác nhau về chức năng, vị trí tế bào và các đặc điểm sinh hóa (hình 1) [15,16].
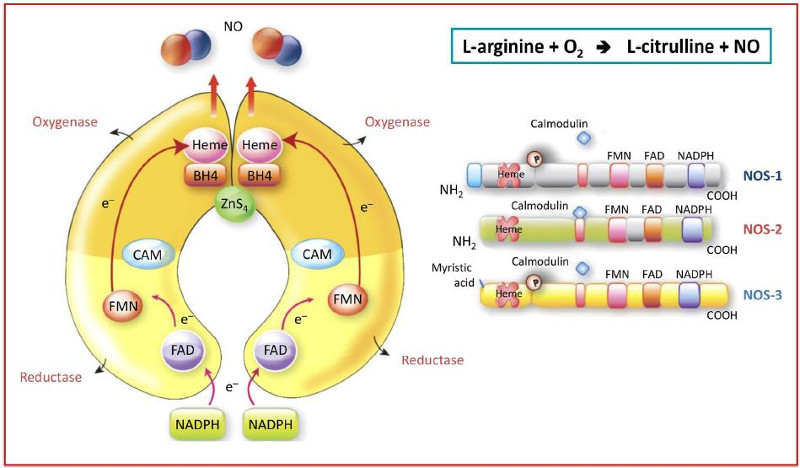
Hình 1 – Ba dạng đồng phân của NO synthases.
NOS-1 và NOS-3 là đồng phân cơ cấu, trong khi dạng NOS-2 là cảm ứng vì chỉ xuất hiện khi có tình trạng bệnh lý chẳng hạn như sốc nhiễm khuẩn hoặc bệnh lý viêm mạn tính, trong đó có hen. Kích thích các đồng phân cơ cấu (NOS-1 và NOS-3) dẫn đến sự sản xuất ngắn hạn NO ở một lượng rất nhỏ với các vai trò sinh lý khác nhau dưới điều kiện sinh lý, từ việc điều hòa trương lực mạch máu đến các cơ chế thần kinh liên quan đến trí nhớ. Do đó, 2 dạng đồng phân này gần như hiện diện khắp nơi và giữ các vai trò sinh lý cơ bản của cơ thể. Ngược lại, một khi có kích thích gen tạo NOS-2 (gen mã hóa cho NOS-2 bình thường không thể hiện trong tế bào), sẽ dẫn đến tổng hợp mới protein này và trở nên hoạt động liên tục một khi xuất hiện. Do đó, hoạt động của NOS-2 chịu trách nhiệm nhiều hơn so với NOS cơ cấu cho sự tăng sản xuất NO. Đường hô hấp là một trường hợp ngoại lệ mà ở đó NOS cảm ứng thường xuyên hiện diện trong biểu mô phế quản, do hậu quả của việc tiếp xúc thường xuyên với các tác nhân môi trường bên ngoài. Điều này giải thích vì sao tồn tại nồng độ NO tương đối cao và có thể đo được trong khí thở ra. Trong điều kiện bình thường cơ bản, các dạng đồng phân protein NOS hiện diện trong các phế nang ở một nồng độ thấp hơn so với trong phế quản.
L-arginine còn là chất nền của arginases. Hai con đường (NOS và arginase) liên quan mật thiết và sự giảm NO được ghi nhận trong vài tình huống (mủ phế quản) có thể được giải thích là không chỉ do giảm hoạt động của NOS mà còn do sự tiêu thụ chất nền arginine theo sau sự hoạt hóa arginase. NO vừa là một gốc oxy hóa tự do vừa là một chất cận tiết được tổng hợp bởi đa số các tế bào trong cơ thể. Nhờ vào bản chất hóa học này mà NO tương tự như chất giãn mạch nitro nội sinh có vai trò sinh lý quan trọng giải thích vai trò điều trị của các dẫn xuất nitrate trong hơn một thập kỷ điều trị bệnh lý tim mạch. Sự hiểu biết về vai trò và tầm quan trọng của NO trong sinh lý hô hấp thì mới được phát triển trong thời gian gần đây [17]. Tuy nhiên, hiện nay vẫn còn khá nhiều tranh luận về vai trò thực sự của NO trong việc điều hòa trương lực phế quản và sinh lý bệnh học hen. Các ý kiến này có thể xếp vào 4 nhóm lớn:
- NO là chất khí hòa tan cao. Do đó trước hơn hết là một chất trung gian thông tin giữa các tế bào trong đường thở;
- NO được tổng hợp từ nhiều tế bào ở phổi (hình 2), đặc biệt ở biểu mô phế quản và các tế bào thần kinh hệ không-cholinergic-không-adrenergic ức chế cây phế quản – phổi;
- Cơ trơn phế quản chứa enzyme NO cảm ứng;
- Sự sản xuất NO nội sinh có thể bị ảnh hưởng bởi 2 cơ chế chính của nhiều bệnh lý phế quản – phổi: viêm phế quản và hút thuốc lá.
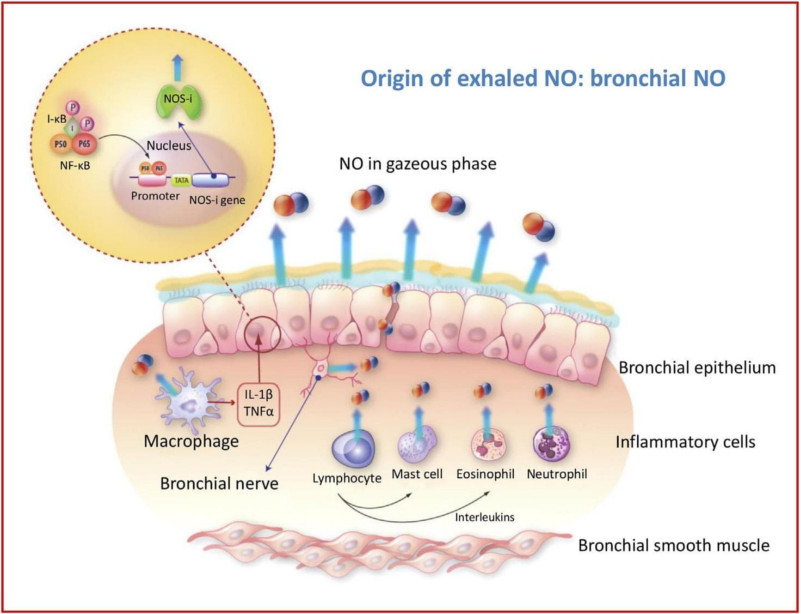
Hình 2 – Nguồn gốc tế bào của NO trong đường hô hấp
CÁC CÔNG NGHỆ ĐO NO
Trên thực tế, việc đo NO chỉ đơn giản là phân tích khí NO trong một lần thở ra. Việc phân tích mối tương quan giữa vận tốc lưu lượng dòng khí thở ra với nồng độ NO cho phép xác định nguồn gốc tạo ra NO từ phế quản và trong phế nang và giúp phân biệt nồng độ NO từng phần của 2 thành phần riêng biệt này. Các kỹ thuật đo khác giúp định lượng chính xác hơn và chỉ với thể tích khí lưu thông đang được nghiên cứu phát triển.
Công nghệ đo NO đầu tiên (phép đo tham chiếu) sử dụng phương pháp hoá huỳnh quang, bằng cách đếm số photon phát ra từ các phân tử NO 2 trong quá trình trở về mức hằng định. Phân tử NO 2 là sản phẩm từ phản ứng hoá học của NO khi tiếp xúc với ozone thừa trong không khí: tín hiệu huỳnh quang đo được tỷ lệ thuận với nồng độ NO trong khí được đo và đơn vị được tính bằng ppb (10 -9 L/L: part per billion). Các triển khai lý thuyết sẽ được mô tả chi tiết bên dưới và hầu hết các nghiên cứu ban đầu đều được thực hiện bằng kỹ thuật đo này. Giá thành của các công cụ đo này rất cao, do đó chỉ được trang bị tại một số ít viện trường lớn trên thế giới.
Kỹ thuật đo dựa trên phương pháp điện hoá học đã được phát triển sau đó như là một công nghệ thay thế với ưu điểm có thể xách tay, đo 1 lần, với lưu lượng thở ra duy nhất 50 mL/giây và đã được khuyến cáo bởi các hội nghị quốc tế. Phương pháp này ít phù hợp khi đo NO nồng độ thấp. Hiện nay, đã có ít nhất 3 loại thiết bị sử dụng kỹ thuật này được lưu hành trên thị trường. Với giá thành giảm hơn rất nhiều so với thiết bị đầu tiên sử dụng hoá huỳnh quang, máy đo NO thế hệ mới này đã được phổ biến rộng rãi hơn, thậm chí đã được trang bị tại các cơ sở y tế công.
PHÉP ĐO NO THỞ RA
Phép đo NO đặc biệt tùy thuộc vào quan hệ giữa nồng độ NO hay phân suất NO thở ra (FeNO) đo được với lưu lượng thở ra [18, 19]. Mối quan hệ này cho phép giải thích về mặt lý thuyết (mô hình phân tích phụ thuộc) và hiệu quả kỹ thuật (những các điều kiện cho phép so sánh các phương pháp đo).
Các phép đo sử dụng các mô hình trao đổi NO trong đường thở
Hầu hết các lý thuyết được triển khai về những mô hình này đều đã được mô tả bởi nhóm tác giả Steven George và độc giả có thể tham khảo các bài báo mô tả các lý thuyết cơ bản này [20]. Trong mô hình được mô tả bởi nhóm tác giả này (hình 3), khí NO sinh ra trong đường hô hấp có nguồn gốc từ 2 thành phần giải phẫu chính: đường thở và phần xa của phổi. Phần có thể co giãn (phần xa của phổi) chứa một lượng NO rất thấp và thay đổi theo chu kỳ hô hấp. Tuy nhiên NO có nguồn gốc từ phần xa của phổi (còn gọi là NO phế nang, alveolar NO concentration, CANO) được xem như hằng định sau 8 – 10 giây ngưng thở hoặc thở ra liên tục vì khi đó sự sản xuất tại chỗ và sự trao đổi qua giường mao mạch đạt được sự cân bằng. Dòng khí lúc này nhận thêm NO trong đường dẫn khí (airway flux NO, J’awNO) khi đi qua các phế quản. Do vậy, sự đóng góp của đường thở được đặc trưng bởi một lượng (J’awNO) tương ứng với vận tốc lưu lượng tối đa NO có thể tạo ra từ phế quản khi không có yếu tố nào cản trở sự vận chuyển NO. Khi lưu lượng thở ra thấp (khoảng 50 mL/giây), NO thu được có nguồn gốc chủ yếu từ phế quản. Một số đại lượng khác phản ánh sự trao đổi NO có thể được xác định và tính toán [20] nhưng không được mô tả chi tiết trong bài viết này. Những đại lượng này có ưu điểm là không phụ thuộc vào lưu lượng thở ra và ưu điểm của chúng về mặt lý thuyết của chúng cho phép phân định phần NO được tạo ra bởi phần xa của phổi và bởi đường dẫn khí. Do vậy, phương pháp này chính là xét nghiệm chức năng phổi không xâm lấn duy nhất cho phép đánh giá tình trạng viêm ở phần xa của phổi. Trên thực tế, phép đo này đòi hỏi phải thực hiện vài lần thở ra ở nhiều mức lưu lượng hằng định khác nhau, hoặc 1 lần thở ra với lưu lượng giảm dần sau 1 động tác ngưng thở, hoặc 1 lần đo khi hô hấp bằng toàn bộ thể tích khí lưu thông (2 phương pháp sau đòi hỏi phép toán trong môi trường nghiên cứu [21]) bằng các thiết bị hóa huỳnh quang (do nồng độ NO thấp khi vận tốc lưu lượng cao). Mô hình này đã được chứng nhận trên cả người khoẻ mạnh và người có bệnh lý [22-25].
Chìa khoá chủ yếu cần nhớ đó là hầu hết lượng NO trong khí thở ra đo được ở lưu lượng thở ra thấp (50 mL/giây) có nguồn gốc từ đường dẫn khí (phế quản). Trong quá trình dị ứng (có hoặc không kèm hen), sự sản xuất NO đường dẫn khí (J’awNO) tăng lên [26], giải thích cho sự tăng lên của FeNO. Trong bệnh hen, J’awNO (và FeNO) tương quan với viêm đường hô hấp có bạch cầu ái toan [27, 28]. Ở một vài BN hen, có tình trạng tăng NO ở phần xa của phổi (CANO) nhưng điều này cần phải được nghiên cứu làm rõ thêm [29].
Phương pháp đo NO trong khí thở ra trong một lần thở ra
Đây là phương pháp đo được thực hiện rộng rãi nhất và giúp cung cấp thông tin trả lời cho các vấn đề của các BS lâm sàng. Các hội nghị đồng thuận đã mô tả rõ các phương thức đo này, và nhấn mạnh chủ yếu vào việc tránh nhiễm NO từ vùng mũi xoang, và sự phụ thuộc của nồng độ NO trong khí thở ra tuỳ theo lưu lượng thở ra. Nhiều yếu tố liên quan đến điều kiện đo hoặc đến người được đo (các đặc điểm hình thái học, việc dùng thuốc, các bệnh lý đồng nhiễm) có thể ảnh hưởng đến kết quả đo NO (bảng 1). Ba điểm then chốt trong khi thực hiện phép đo NO thở ra trong một hơi thở ra đó là:
- Thở ra trực tiếp chống lại kháng lực vùng miệng (5 – 15 cmH2O). Khí NO được sản xuất từ vùng mũi họng sẽ không lẫn vào NO có nguồn gốc từ đường thở dưới nhờ sự đóng của khẩu cái mềm trong thì thở ra.
- Lưu lượng thở ra hằng định: các khuyến cáo của các hội đồng học thuật ban đầu có vẻ trái ngược nhau (200 mL/giây của ESR so với 50 mL/giây của ATS [30, 8]). Hội nghị
đồng thuận mới nhất đã khuyến cáo lưu lượng thở ra là khoảng 50 ± 5 mL/giây [31], tuy nhiên với khả năng vẫn áp dụng các vận tốc lưu lượng khác tùy thuộc vào loại thông tin cần tìm kiếm (viêm ở phần xa nên được đánh giá với các vận tốc lưu lượng thở ra cao).
- Thời gian thở ra: phải ít nhất là 6 giây đối với người lớn và 4 giây đối với trẻ < 12 tuổi. Phân suất NO đo được là giá trị trung bình trong giai đoạn bình nguyên kéo dài ít nhất 3 giây, và sự chênh lệch giữa giá trị cao nhất với giá trị thấp nhất của giai đoạn bình nguyên này là không quá 10%.
Giai đoạn đầu của thì thở ra, thường là lúc NO đạt đỉnh cao nhất, một mặt tương ứng với giai đoạn thoát khí từ các khoảng chết, và mặt khác tương ứng với thời gian cần thiết để đạt được giai đoạn ổn định, đặc biệt là trong khoảng phế nang.
Trong trường hợp NO được sản xuất ở biểu mô mũi nhiều thì cũng không khuyến cáo sử dụng nẹp mũi vì nguy cơ lẫn NO từ vùng mũi miệng với NO phế quản. Khí NO trong không khí không ảnh hưởng đến kết quả đo, trừ khi nồng độ NO trong môi trường tăng cao trong một khoảng thời gian dài (>50 ppb trong vài giờ) thì có khả năng làm giảm hoạt động tổng hợp NO nội sinh. Hầu hết các cá thể, sự khác biệt FeNO giữa các cá thể thì không quá 10 – 15% [33] nhưng sự lặp lại chính xác này sẽ không ghi nhận thấy ở một vài bệnh nhân, đặc biệt là bệnh nhân cơ địa dị ứng, mà không thể mô tả rõ đặc điểm nhóm đối tượng này. Động tác thở ra gắng sức làm giảm FeNO, do đó khuyến cáo nên đo FeNO trước bất kỳ test đo chức năng hô hấp nào, và ít nhất 30 phút sau khi vận động thể lực kéo dài.
Kết quả của một phép đo FeNO được mô tả như sau: FeNO0.05 = 10ppb, nghĩa là nồng độ NO đo được trong ít nhất 3 giây ở giai đoạn 2 của thì thở ra với lưu lượng thở ra là 0,05 L/giây (hoặc FeNO50 cho đơn vị 50 mL/giây) là 10 ppb. Phép đo này dễ dàng thực hiện ở đối tượng từ 8 – 9 tuổi trở lên. Khó khăn chính của phép đo chính là làm sao giữ được lưu lượng thở ra được ổn định, do đó một số thiết bị được trang bị bộ phận kiểm soát lưu lượng, nhờ đó mà tăng độ tin cậy của phép đo và có thể áp dụng cho trẻ khoảng 4 – 5 tuổi.
|
Bảng 1 - Các yếu tố có khả năng ảnh hưởng phép đo FeNO (ngoài cơ địa dị ứng và viêm phế quản |
|
Các yếu tố làm tăng NO thở ra |
|
- Kích thước cơ thể |
|
- Tuổi |
|
Ở trẻ em (có khả năng liên quan đến kích thước) |
|
- Viêm mũi |
|
- Nhiễm trùng phổi |
|
- Thức ăn |
|
Nồng độ nitrat cao |
|
Các yếu tố làm giảm NO thở ra |
|
- Hút thuốc lá |
|
Hút thuốc lá chủ động hoặc thụ động |
|
- Corticosteroid |
|
Đường uống hoặc đường hít |
|
- Các thao tác tập luyện hô hấp |
|
- Cà phê |
NO, VIÊM PHỔI VÀ HEN
Tình trạng viêm hô hấp dẫn đến sự tăng tổng hợp NO bởi các tế bào viêm bằng cách hoạt hóa NO synthases cảm ứng (iNOS hay NOS-2) qua cơ chế phụ thuộc NF-ĸB. Nhờ bản chất là chất khí nên NO được tổng hợp tại phổi hiện diện ở thể khí và được khuếch tán từ môi trường có nồng độ cao đến môi trường có nồng độ thấp dọc theo chiều dài đường dẫn khí. Sự gia tăng tổng hợp NO ở phổi dẫn đến tăng NO trong khí thở ra mà thể tích này có thể định lượng được bằng nhiều phương pháp khác nhau (hóa huỳnh quang hoặc hoặc điện tử). Nồng độ NO cao trong khí thở ra thường gặp trong viêm đường dẫn khí cấp hoặc mạn (hen, viêm phế quản cấp do virus hoặc vi trùng, viêm phổi, các bệnh hệ thống tự miễn có ảnh hưởng đến phổi). Hai bệnh lý nằm ngoài quy luật này: bệnh xơ nang (mà các nguyên nhân chưa được sáng tỏ) [11] và bệnh phổi tắc nghẽn mạn tính có liên quan đến thuốc lá (cơ chế là sự ức chế tổng hợp NO nội sinh do nồng độ quá cao của NO ngoại sinh chứa trong khói thuốc lá).
Hen là bệnh lý viêm đường dẫn khí. Trong hen, viêm đường dẫn khí là một quá trình mạn tính, mà ở đó mức độ thay đổi theo thời gian và liên quan đến tình trạng tăng đáp ứng và tắc nghẽn phế quản, và có sự tái cấu trúc chứng minh trên mô học. Có các kiểu hình viêm trong hen: kiểu hình hen có bạch cầu ái toan, hoặc bạch cầu trung tính, hoặc dạng hỗn hợp, hoặc dạng chỉ chứa một vài tế bào viêm. Kiểu hình chủ yếu của viêm trong hen là có bạch cầu ái toan thì nhạy với corticoid và sự hiện diện của bạch cầu ái toan trong dịch tiết phế quản có tương quan chặt chẽ với sự tăng NO trong khí thở ra [34, 35].
GIÁ TRỊ TIÊN ĐOÁN CỦA NO TRONG CHẨN ĐOÁN HEN
Đo NO trong khí thở ra có thể giúp chẩn đoán hen khi các triệu chứng lâm sàng không điển hình và test chức năng phổi bình thường [36-42]. Thực vậy, nồng độ NO cao trong khí thở ra có tương quan với viêm đường dẫn khí, và chính nó cũng tương quan với các triệu chứng lâm sàng gợi ý hen, là một lý lẽ rất mạnh trong bệnh lý này (Bảng 2).
Bảng 2 – Độ đặc hiệu, độ nhạy, giá trị tiên đoán của đo NO trong bệnh hen. Cần lưu ý rằng NO trong khí thở ra luôn có giá trị tiên đoán âm cao qua nhiều nghiên cứu.
|
Chỉ định |
Ngưỡng (ppb) |
Độ nhạy (%) |
Độ đặc hiệu (%) |
Giá trị tiên đoán dương (%) |
Giá trị tiên đoán âm (%) |
Tác giả (tham khảo) |
|
Chẩn đoán hen ở người có |
||||||
|
Các triệu chứng hô hấp không đặc hiệu |
20
|
88 |
79 |
70 |
92 |
Smith và cs. [36] |
|
Ho mạn tính |
30 |
75 |
87 |
60 |
93 |
Chatkin và cs. [37] |
|
40 |
88 |
83 |
73 |
93 |
Kowal và cs.[38] |
|
|
32 |
86 |
76 |
47 |
95 |
Oh và cs. [39] |
|
|
Đáp ứng với glucocorticoids ở người có |
||||||
|
Các triệu chứng hô hấp không đặc hiệu |
47 |
82 |
91 |
82 |
91 |
Smith va cs.[40] |
|
Ho mạn tính |
38 |
90 |
85 |
90 |
85 |
Hahn và cs.[41] |
|
Hen nặng |
30 |
88 |
91 |
88 |
91 |
Pérez-de-Llano và cs.[42] |
Trong bối cảnh này thì việc đo NO trong khí thở ra còn có giá trị tiên đoán tốt hơn các test đo chức năng hô hấp thường làm khác như đo thể tích thở ra gắng sức trong 1 giây (FEV1), tỷ lệ FEV1/ tổng dung tích sống gắng sức (FVC) và và sự thay đổi của lưu lượng đỉnh thở ra (PEF) [36]. Hơn nữa, giá trị dự đoán của FeNO trong chẩn đoán hen là tương đương với các test kích thích phế quản (methacholine, gắng sức, adenosine-5’- monophosphate) [43]. So với các test thử thách phế quản này thì đo FeNO vừa có ưu điểm thực hiện nhanh hơn vừa không có nguy cơ gây co thắt phế quản [43].
GIÁ TRỊ CỦA ĐO NO KHÍ THỞ RA TRONG TIÊN ĐOÁN ĐÁP ỨNG VỚI CORTICOSTEROIDS
Corticosteroids vẫn là điều trị kháng viêm chuẩn trong hen. Sử dụng corticosteroids hít được khuyến cáo như là điều trị nền của hen dai dẳng, trong khi corticosteroids uống thì thường cần thiết trong đa số trường hợp hen nặng. Tuy nhiên, đáp ứng với corticosteroid có sự thay đổi rất lớn giữa các cá thể và, ngay cả trong một cá thể, sự đáp ứng cũng thay đổi theo thời gian tùy theo quá trình diễn biến bệnh hen và độ nặng của viêm.
Trong bối cảnh này, khả năng thực hiện test cá thể tiên đoán độ nhạy với corticoid rất đáng được quan tâm. Rất nhiều bài báo cho thấy nồng độ NO trong khí thở ra, trong sự tương quan với viêm tăng bạch cầu ái toan, thể nhạy cảm với corticoid, là một công cụ tiên đoán tốt hơn so với các tests phổi khác, như đo FEV1, đáp ứng giãn phế quản và sự biến thiên PEFR [40]. Một nghiên cứu mới đây mở rộng giá trị tiên đoán của NO khí thở ra trong đánh giá đáp ứng với corticoid trong các kiểu hình hen khác, kể cả hen không có bạch cầu ái toan [44].
MỐI TƯƠNG QUAN GIỮA ĐO NO TRONG KHÍ THỞ RA VÀ HEN
Theo khuyến cáo quốc tế và của Hội Phổi Pháp, việc chỉnh liều corticosteroid hít là dựa vào mức độ kiểm soát hen mà trong đó thang điểm đánh giá chính là mức độ ổn định của bệnh [45], và từ đó là hiệu quả của điều trị nền. Gọi là kiểm soát hen khi không có triệu chứng ban ngày và ban đêm và không cần sử dụng thuốc giãn phế quản tác dụng nhanh và chức năng hô hấp bình thường, bao gồm cả FEV1 [45]. Mất kiểm soát hen là một chuyển biến quan trọng trong quá trình bệnh lý mà cần phải thay đổi phương cách điều trị (như tăng liều corticoids hít, chuyển sang dạng uống…). Mất kiểm soát hen có thể là dấu hiệu của đợt kịch phát hen sắp xảy ra mà đòi hỏi một liệu trình corticosteroid uống hoặc phải nhập viện.
Đo NO trong khí thở ra cho phép tiên đoán hen đang được duy trì kiểm soát tốt với giá trị tiên đoán dương trên 95% khi NO nhỏ hơn 40 ppb [46]. Sự thay đổi nồng độ NO thở ra cũng có mối tương quan với mức độ kiểm soát hen: khi chỉ số này giảm từ 40% trở lên so với chỉ số ban đầu thì tương đương với hen đang được kiểm soát tốt [47]. Tương tự, cải thiện kiểm soát hen thậm chí rõ ràng hơn khi nồng độ NO ban đầu là cao (trên 30 ppb) [42, 47]. Ngược lại, mất kiểm soát hen có mối liên quan có ý nghĩa với sự tăng tối thiểu 30% giá trị FeNO giữa hai lần đo trên BN hen không kèm viêm mũi dị ứng (và sự gia tăng tối thiểu 40% với BN hen kèm viêm mũi dị ứng) [48].
Các BS nhi khoa thường có khuynh hướng ngưng corticosteroid khi hen đang được kiểm soát tốt để giảm các tác dụng phụ trên sự phát triển của trẻ, nhưng những bệnh nhi đang ngừng corticoid này vẫn có nguy cơ tái phát triệu chứng sau đó. Trong bối cảnh này, khi FeNO tăng sớm trở lại sẽ dự báo tình trạng viêm phế quản trở lại và các triệu chứng lâm sàng sẽ xảy ra vài ngày đến một ít tuần sau đó [49].
VAI TRÒ CỦA ĐO NO TRONG ĐIỀU CHỈNH LIỀU CORTICOSTEROID HÍT
Lý tưởng nhất là liều corticosteroid được cân chỉnh tùy theo tình trạng có hoặc không có viêm, tuy nhiên, các triệu chứng lâm sàng (số cơn khởi phát trong ngày và về đêm) và cả các phép đo chức năng hô hấp (FEV1, PEF, test kích thích phế quản) cũng không đủ nhạy để giúp các BS lâm sàng điều chỉnh liều corticosteroid tùy theo diễn tiến bệnh. Ưu điểm của việc đo nồng độ NO trong khí thở ra trong việc chỉnh liều ICS đã được đề cập đến trong vài nghiên cứu mù đôi, có nhóm chứng trên cả trẻ em lẫn người lớn. Smith và cộng sự [50] đã chứng minh sự thay đổi điều trị dựa vào FeNO giúp giảm được liều corticosteroid mà không làm xấu hơn mức độ kiểm soát hen. Trong nghiên cứu mù đơn này của Smith, 97 BN hen từ 12 đến 73 tuổi, trong giai đoạn đơn trị liệu với corticosteroid, đã được phân nhóm ngẫu nhiên thành 2 nhóm: một nhóm được chỉnh liều ICS dựa vào chiến lược thông thường là mức độ kiểm soát hen, và nhóm còn lại thì chỉ dựa vào FeNO [50]. Nhóm tác giả đã ghi nhận thấy chiến lược giảm liều dựa vào FeNO cho phép giảm một cách có ý nghĩa fluticason 270µg/ngày, và không có sự khác biệt về mức độ kiểm soát hen và tần suất cơn kịch phát giữa 2 nhóm can thiệp [50]. Một nghiên cứu mù đơn trên 118 BN hen từ 20 đến 81 tuổi cũng phân nhóm ngẫu nhiên tương tự với 2 chiến lược can thiệp tương tự [51]. Cũng vậy, không có sự khác biệt về mức độ kiểm soát hen và tần số cơn kịch phát giữa 2 nhóm đối tượng [51]. Đến cuối cuộc nghiên cứu, nhóm chiến lược điều trị dựa trên NO thở ra cho phép giảm liều corticosteroid hít đến 338 µg/ngày nhưng nhìn chung, qua 12 tháng nghiên cứu, sự khác biệt không có ý nghĩa thống kê [51]. Đối với các nghiên cứu mù đôi, nghiên cứu đầu tiên trên 546 bệnh nhân không kiểm soát hen tuổi từ 12 đến 20 được phân nhóm ngẫu nhiên thành chiến lược thông thường và nhóm vừa chiến lược thông thường vừa phối hợp đo NO thở ra [52].
Như trên, không có sự khác biệt về mức độ kiểm soát hen và tần số cơn kịch phát giữa 2 nhóm đối tượng, nhưng ở đây liều corticosteroid cũng không giảm ở bên nhóm vừa chiến lược thông thường vừa phối hợp đo NO thở ra [52]. Tuy nhiên, theo phân tích của Szefler và cộng sự dựa trên NO thở ra sẽ cho phép tăng liều corticosteroid hít (ICS) thậm chí ngay cả khi kiểm soát lâm sàng tối ưu, trong khi đó liều này không thể giảm nếu chỉ dựa vào NO thấp, chỉ trừ khi các thông số khác cũng đều được kiểm soát [52]. Trên đối tượng trẻ em hen, có 2 nghiên cứu can thiệp đã được thực hiện. Công trình đầu tiên có 89 trẻ hen trung bình và nặng, 6 – 18 tuổi, được phân nhóm ngẫu nhiên: 1 nhóm được áp dụng chiến lược điều trị chỉ dựa vào triệu chứng lâm sàng, và nhóm còn lại phối hợp thêm chỉ số FeNO, tái khám mỗi 3 tháng [53]. Liều ICS, mức độ kiểm soát hen và tần suất cơn hen kịch phát không khác nhau giữa 2 nhóm. Tuy nhiên, ở nhóm có FeNO, có sự cải thiện có ý nghĩa thống kê về FEV1 và test kích thích phế quản, trong khi không có sự khác biệt nào được tìm thấy trong nhóm chỉ dựa vào triệu chứng lâm sàng [53]. Nghiên cứu can thiệp tiếp theo bởi cùng một nhóm tác giả này, 151 trẻ 6 – 18 tuổi bị hen dị ứng mức độ nhẹ đến trung bình cũng được phân nhóm ngẫu nhiên tương tự nghiên cứu trước, nhưng được theo dõi sát mỗi ngày qua liên lạc điện thoại [54]. Cả 2 chiến lược đều giúp cải thiện mức độ kiểm soát hen và giảm liều ICS, nhưng không có sự khác biệt có ý nghĩa thống kê giữa 2 nhóm [54]. Tuy nhiên, cũng giống nghiên cứu trước đó, cả 2 thử nghiệm này có số cỡ mẫu không đủ để thấy được sự khác biệt có ý nghĩa thống kê về số cơn kịch phát giữa 2 nhóm [54].
Một nghiên cứu phân nhóm ngẫu nhiên có đối chứng gần đây cho thấy phụ nữ mang thai bệnh hen mà được điều chỉnh liều corticosteroid dựa trên nồng độ NO khí thở ra thì có ít số cơn hen kịch phát hơn so với nhóm chứng [55]. Tần suất nhập viện khoa hồi sức tích cực của các trẻ sơ sinh từ bà mẹ hen được theo dõi bằng NO thở ra thì thấp hơn có ý nghĩa thống kê so với nhóm chứng [55]. Trong nghiên cứu mù đôi này, 220 phụ nữ mang thai bệnh hen với độ tuổi trung bình là 28 tuổi được phân nhóm ngẫu nhiên để nhận được chiến lược thông thường hoặc chiến lược thông thường được phối hợp với đo NO thở ra [55]. Không giống với các nghiên cứu trước đó, số cơn hen kịch phát và số lần cần thiết sử dụng đồng vận ß2 giảm ở nhóm chiến lược dựa trên NO. Hơn nữa, số trẻ sơ sinh nhập viện cũng giảm có ý nghĩa [55]. Sau cùng, trong một nghiên cứu mù đôi khác, 342 bệnh nhân hen người lớn từ nhẹ đến trung bình được phân nhóm ngẫu nhiên vào một trong ba chiến lược sau: chiến lược dựa vào FEV1 và triệu chứng, chiến lược dựa trên NO thở ra và chiến lược chỉ dựa vào triệu chứng [56]. Không có sự khác biệt về thời gian thất bại điều trị.
Một phân tích gộp (meta-analysis) mới đây bao gồm vài phân tích gộp trước đó và hai bài tổng quan của Cochrane chỉ ra rằng việc sử dụng NO thở ra cho phép giảm corticosteroid hít có ý nghĩa thống kê ở người lớn nhưng không ở trẻ em [57]. Tuy nhiên, cũng theo phân tích này, việc sử dụng NO thở ra không cho phép giảm số bệnh nhân có ít nhất một lần xảy ra cơn hen kịch phát [57]. Đáng chú ý là bài phân tích tổng hợp này đã không tính đến nghiên cứu của tác giả Powell [55]. Ngược lại, một bài phân tích gộp mới hơn, có tính đến các nghiên cứu trên đối tượng người lớn của các tác giả Smith [50], Shaw [51] và Powell [55], thì thấy rằng tần suất cơn kịch phát hen giảm có ý nghĩa thống kê khi áp dụng chiến lược điều trị dựa trên NO thở ra [58]. Hầu hết, các bằng chứng đều ủng hộ cho việc sử dụng NO thở ra để chỉnh liều corticosteroid hít trên người lớn. Còn ở trẻ em, các bằng chứng chính thống vẫn chưa có đầy đủ, nhưng các quy trình hiệu quả nhất ở người lớn đã không được sử dụng. Hơn nữa, mặc dù vài nghiên cứu có đối chứng cho các kết quả trái chiều nhau về vai trò của NO thở ra trong bệnh hen ở người lớn và trẻ em, sự không nhất quán này do kỹ thuật (lưu lượng thở ra trong cách lấy mẫu, ngưỡng nồng độ NO lựa chọn để tăng hoặc giảm liều corticosteroids) và/hoặc do phương pháp (chọn lựa mục tiêu chính: kiểm soát hen với số cơn hen kịch phát). Sự không thuần nhất về quần thể hen (các bệnh nhân với các độ nặng bệnh hen khác nhau) cũng có thể là một nguyên nhân giải thích cho sự không nhất quán giữa các nghiên cứu phân nhóm ngẫu nhiên khác nhau cho đến thời điểm hiện tại. Đo nồng độ NO trong khí thở ra ở phụ nữ mang thai cho phép kiểm soát hen tốt hơn trên đối tượng này [55].
LỢI ÍCH CỦA ĐO FENO ĐỂ ĐÁNH GIÁ TUÂN THỦ ĐIỀU TRỊ CỦA BN HEN
Tuân thủ kém của BN với điều trị nền là một trong những nguyên nhân chính của kiểm soát hen kém [59-61]. Tuy nhiên, trong thực hành lâm sàng, không có phương pháp nào đủ tin cậy để đánh giá tuân thủ điều trị. Với bằng chứng nồng độ NO trong khí thở ra thay đổi theo mức độ viêm phế quản và theo mức độ kiểm soát hen khi điều trị nền cho phép gợi ý lợi ích của phép đo này trong đánh giá mức độ tuân thủ điều trị của BN. Hơn nữa, có thể đặt giả thuyết rằng một trong những nguyên nhân làm tăng FeNO trên một người bệnh đang điều trị corticoid hít có thể do tuân thủ không đầy đủ. Giả thuyết này đã được làm rõ hơn qua các nghiên cứu đã thực hiện trên trẻ em [62-64]. Một nghiên cứu thực hiện trên 31 trẻ hen (6 – 15 tuổi) đã cho thấy mối tương quan mạnh giữa sự thay đổi FeNO và mức độ tuân thủ sử dụng budesonide (đo dựa trên Turbuhaler định liều) [62].
Một nghiên cứu khác thực hiện trên 30 bệnh nhi hen (7 – 17 tuổi) cũng đã chứng minh mối tương quan có ý nghĩa thống kê cao giữa giá trị FeNO đo được và mức độ tuân thủ dựa vào lời khai của các bệnh nhi [63]. Cano-Garcinuno và cs [64] đã chọn ra 151 trẻ bị hen tuổi từ 6 đến 14 và nghiên cứu mối liên quan giữa phép đo FeNO và một chuỗi các dữ liệu về lâm sàng và chức năng hô hấp. Kết quả chính của nghiên cứu này là trên những bệnh nhi được điều trị bằng ICS, chỉ có một yếu tố duy nhất có liên quan với giá trị FeNO có ý nghĩa thống kê đó là mức độ tuân thủ điều trị dựa trên lời khai của trẻ và cha mẹ trẻ. Tuy nhiên, Katsara và cs [65] thực hiện phép đo FeNO trên 20 bệnh nhi hen từ 7 đến 14 tuổi đo 4 lần cách nhau 1 tháng và ghi nhận mức độ sử dụng ICS bằng 1 máy điện tử, cho thấy mối tương quan không có ý nghĩa thống kê. Tuy nhiên, ở nghiên cứu này, không có bằng chứng nào cho thấy tất cả các BN này có FeNO cao từ trước dù không điều trị kháng viêm, và tác giả cũng công nhận kém tuân thủ điều trị có vẻ là giải thích hợp lý nhất cho việc tăng FeNO nhưng cũng không phải là yếu tố duy nhất.
Một công trình gần đây đã tái khẳng định giả thuyết ban đầu này [66]. Theo đó, tác giả phân loại các BN có kiểm soát hen kém và FeNO ban đầu cao (> 45 ppb) thành 2 nhóm. BN được gọi là “có tuân thủ” và “không tuân thủ điều trị” tùy thuộc vào tốc độ kê toa thuốc mới lặp lại (> 80% hoặc < 50%). Trong giai đoạn đầu, nhóm 9 BN “không tuân thủ” và 13 BN “tuân thủ” được nhận ICS (budesonide 1600 µg/ngày) và theo dõi liên tục trong 7 ngày. Sau giai đoạn này, FeNO tăng có ý nghĩa ở nhóm “không tuân thủ” so với nhóm còn lại (79% so với 47%). Và ngưỡng để phân định giữa “tuân thủ” và “không tuân thủ” được tính toán dựa theo biên độ giảm FeNO sau 5 ngày điều trị, đó là gọi là có tuân thủ khi log10ΔFeNO ≥ 0,24. Trong giai đoạn 2 của nghiên cứu, 40 BN hen khác cũng có FeNO cao (> 45 ppb) được nhận ICS và được theo dõi sát trong 5 ngày và sau đó được phân loại thành 2 nhóm “tuân thủ” và “không tuân thủ” dựa trên công thức đã nêu ở phần trước của nghiên cứu. Theo đó, có 13 người được xếp vào nhóm “không tuân thủ”. Khi so sánh với thang điểm mức độ tuân thủ (dựa vào các yếu tố: toa thuốc hiện tai, khai thác bệnh, xét nghiệm máu như cortisol huyết thanh…) thì với ngưỡng đã chọn thì có giá trị tiên đoán dương là 92% và giá trị tiên đoán âm là 78%. Từ đó, tác giả kết luận rằng tầm quan trọng của sự giảm FeNO khi đang điều trị ICS giúp phân định giữa người “có tuân thủ” và người “không tuân thủ” điều trị. Rõ ràng, nghiên cứu này chỉ có thể áp dụng cho bệnh nhân hen có chỉ số FeNO ban đầu cao và có giảm dưới hiệu quả điều trị; vì thế, những nghiên cứu tiếp theo cần phải thực hiện để khẳng định lại kết quả này. Tuy nhiên, với tất cả dữ liệu hiện nay gợi ý rằng FeNO có thể giúp phân định những bệnh nhân tuân thủ kém trong nhóm có FeNO ban đầu cao.
ĐÓNG GÓP CỦA VIỆC ĐO NO TRONG HEN NGHỀ NGHIỆP
Trong lĩnh vực nghiên cứu về sức khỏe hô hấp nghề nghiệp, đo FeNO đang được lồng ghép ngày càng nhiều vào một loạt các test được sử dụng và được dùng để đánh giá trên những người lao động thuộc nhiều lĩnh vực nghề nghiệp: những người lao động tiếp xúc với động vật phòng xét nghiệm, các loại nội độc tố, gia vị, isocyanate, latex hoặc trên những người nông dân, thợ làm bánh, nhân viên y tế, hướng dẫn viên bơi lội [67-69]. Các nghiên cứu đã quan sát được nồng độ NO thở ra cao ở những người lao động mẫn cảm [69] hoặc tăng cao sau tiếp xúc kháng nguyên đặc hiệu ở những người lao động mẫn cảm [67,70,71]. Sự tăng NO thở ra này được quan sát thấy sau 24 – 48 giờ sau tiếp xúc kháng nguyên trong môi trường lao động [67]. Tuy nhiên, vài nghiên cứu khác cho thấy rằng không có sự liên quan giữa NO thở ra và các kết quả test thử thách kháng nguyên đặc hiệu hoặc nồng độ IgE đặc hiệu với latex, diisocyanates và triglycidyl isocyanurate [72,73] hoặc giữa sự tăng NO thở ra và sự tăng tiếp xúc với crôm và cô-ban [74]. Trong một nghiên cứu bệnh – chứng trong lĩnh vực nghề lao công, NO thở ra ở bệnh nhân hen không cao hơn so với người không hen, nhưng lại cao hơn khi có sử dụng các sản phẩm lau chùi đa năng [75]. Trên những thợ học việc làm bánh hoặc cắt tóc trong quá trình học việc, NO thở ra tăng ứng với các sự kiện tăng đáp ứng phế quản không đặc hiệu [76]. NO thở ra không tăng ở nhân viên bệnh viện có tiếp xúc với chất tẩy rửa so với các nhân viên bệnh viện không tiếp xúc chất này, trong khi đó, các chất đánh dấu sinh học khác của viêm và stress oxy hóa lại tăng ở nhóm có tiếp xúc so với nhóm còn lại, điều đó có thể gợi ý do cơ chế kích thích hơn là cơ chế dị ứng [77]. Một nghiên cứu trên thợ học việc làm bánh và cắt tóc nhằm so sánh hiệu quả của việc đo NO thở ra so với phế dung ký trong việc theo dõi sức khỏe hô hấp đã cho thấy mỗi loại test cung cấp một thông tin của hệ hô hấp và cho phép nhận diện những đối tượng cần làm các xét nghiệm chuyên sâu hơn [78]. Một nghiên cứu trên người lao động tiếp xúc bụi hữu cơ nhiều nội độc tố cho thấy NO thở ra, cũng như các chất chỉ điểm viêm đường thở khác, giảm có ý nghĩa thống kê sau một năm ngưng tiếp xúc [79]. Đo NO thở ra và đo hydrogen peroxyde đã được sử dụng để theo dõi tiến triển của bệnh hen gây ra do latex nghề nghiệp ở một y tá vẫn làm tiếp công việc này sau khi hồi phục sức khỏe, cho thấy tái xuất hiện triệu chứng. Mặc dù các test tiêu chuẩn ở phòng thí nghiệm hoặc ở nơi làm việc chỉ thay đổi ít giữa thời điểm làm việc (buổi tối) và thời điểm nghỉ, các số đo này vẫn tăng rõ rệt khi hoạt động nghề nghiệp [80].
Tóm lại, trong lĩnh vực nghiên cứu về sức khỏe hô hấp nghề nghiệp, đo NO trong khí thở ra được sử dụng bổ sung thêm vào các test chức năng và sinh học khác. Trong bối cảnh này, đo NO thở ra có thể giúp theo dõi hậu quả của một vài yếu tố tiếp xúc nghề nghiệp trên sức khỏe hô hấp của người lao động, giúp hiểu các cơ chế sinh lý bệnh và theo dõi các hiệu quả của việc giảm hoặc ngừng tiếp xúc nghề nghiệp.
Về mặt thực hành lâm sàng, ATS đã nói rõ trong phác đồ 2011 rằng đo NO thở ra trước và sau các test thử thách kháng nguyên có thể có lợi trong hen nghề nghiệp [10]. Tương tự, đo NO thở ra trong giai đoạn làm việc và trong giai đoạn nghỉ, cũng như xét nghiệm đàm, giúp cải thiện độ chính xác của chẩn đoán hen nghề nghiệp [81]. Viện hàn lâm châu Âu về dị ứng học và miễn dịch lâm sàng chỉ rõ rằng đo NO khí thở ra, kém đặc hiệu hơn so với đếm tế bào trong đàm, nhưng cũng cung cấp thông tin hữu ích khi xét nghiệm đàm không khả thi, thì thường gặp trong thực tế lâm sàng [82]. Tóm lại, đo NO khí thở ra không thể thay thế các test tham chiếu trong hen nghề nghiệp nhưng nó có thể hỗ trợ chẩn đoán, cũng tương tự các kết quả lấy từ các kỹ thuật không hoặc ít xâm lấn khác như xét nghiệm đàm hoặc ngưng tụ hơi thở ra (exhaled breath condensates) [83].
VỀ SỐ LIỆU KINH TẾ Y TẾ
Việc đo FeNO nhằm phát hiện tình trạng viêm trong bệnh hen đã được bảo hiểm y tế chi trả tại một vài quốc gia châu Âu như Thụy Điển, Hà Lan, Đan Mạch, Na Uy, Ý, Bồ Đào Nha và Cộng hòa Séc. Các nghiên cứu về ảnh hưởng trên kinh tế y tế của phép đo này phải so sánh sự đóng góp của FeNO trong chẩn đoán hen bằng cách so sánh giá trị chẩn đoán của phép đo này so với phế dung ký và các test kích thích phế quản (methacholine, gắng sức,…). Ảnh hưởng trên kinh tế y tế của phép đo này trong theo dõi BN hen cũng phải được đánh giá bằng cách xác định liệu việc đo FeNO có giúp giảm các chi phí liên quan đến điều trị đợt kịch phát và chi phí nằm viện hay không. Các dữ liệu từ 2 nghiên cứu trước đây đã thực hiện tại Đức [84] và Anh [85] đã cho rằng việc đo FeNO cho phép giảm các chi phí liên quan đến chẩn đoán và theo dõi bệnh hen (Bảng 3). Các dữ liệu đáng khích lệ này cũng cần phải được xác định thêm bởi các nghiên cứu thực tiễn khác tại châu Âu cũng như trên thế giới để đánh giá lợi ích kinh tế của FeNO trong quản lý bệnh hen [86].
Bảng 3 – Lợi ích kinh tế y tế của đo NO thở ra trong chẩn đoán và theo dõi hen
|
Quốc gia |
Quy trình |
Chi phí |
Tài liệu tham khảo |
|
Đức |
Chẩn đoán Theo dõi |
+€12 (+€18 nếu FeNO + phế dung ký) -€30 (-€160 đối với trung bình – nặng) +0.055 năm sống chất lượng hiệu chỉnh (QALYs) |
[84] |
|
Anh |
Chẩn đoán Theo dõi |
-₤43 (+₤42 nếu FeNO + phế dung ký) -₤341 (-₤554 đối với trung bình – nặng) +0.06-0.004 năm sống chất lượng hiệu chỉnh (QALYs) |
[85] |
KẾT LUẬN
Cho đến nay, các nghiên cứu ngẫu nhiên vẫn chưa thể cung cấp một câu trả lời rõ ràng về vai trò của phương cách điều chỉnh corticosteroid hít trong hen [57]. Cần ghi nhận rằng cho đến nay không có test chức năng phổi nào chứng minh được lợi ích của chúng trong chỉ định đặc biệt này. Các kết quả trái ngược nhau có thể do liên quan đến sự không đồng nhất trong tiêu chuẩn chọn vào và các mục tiêu chính của các nghiên cứu. Tuy nhiên, cho đến nay vẫn có thể xác định được những tình huống lâm sàng mà ở đó việc đo NO thở ra có thể giúp chẩn đoán và quản lý điều trị hen ở người lớn [87] và trẻ em (Bảng 4). Như vậy, việc áp dụng đo NO khí thở ra rõ ràng cải thiện việc quản lý một vài dân số đích rõ ràng chẳng hạn như phụ nữ mang thai bị hen [55]. Trong chỉ định ban đầu của phép đo, được gọi là đánh giá viêm đường thở không xâm lấn, lợi ích của việc đo NO trong khí thở ra đã được nhiều cộng đồng y khoa tại Pháp và trên thế giới biết đến. Cuối cùng, việc sử dụng các thiết bị cồng kềnh đã góp phần hạn chế test này tại một số phòng thí nghiệm đánh giá chức năng hô hấp. Có vẻ sự bất tiện này sẽ mất đi khi các thiết bị xách tay phổ biến [86, 88-93], từ đó giúp cho các nghiên cứu quy mô lớn và thực tế trở nên thuận lợi hơn. Việc đo NO khí thở ra làm nền tảng cho các test đánh giá viêm đường dẫn khí không xâm lấn, một máy đo tình trạng viêm, theo cách tiếp cận định lượng chất chuyển hóa NO trong khí thở ra, một chất khí chuyển hóa có ở khắp nơi. Như vậy, trong kỷ nguyên đo khí thở ra nhằm phát hiện và theo dõi các bệnh lý hô hấp, các nhà hô hấp ngày nay đã có các công cụ khả dụng nhằm định lượng không chỉ các thể tích và tốc độ lưu lượng thở ra, mà còn là các thành phần hóa học trong đó.
Bảng 4 – Lợi ích của đo NO trong khí thở ra trong phát hiện viêm phế quản trong bệnh hen
|
1. Trên BN có nghi ngờ hen (chưa có chẩn đoán chính thức) và có: a. Các triệu chứng không điển hình hoặc mô tả bệnh không rõ ràng (có hoặc không có cơ địa dị ứng, có hoặc không có tăng đáp ứng phế quản), thì: i. FeNO cao (*) giúp làm mạnh hơn chẩn đoán hen. ii. FeNO thấp (*) không cho phép loại trừ hen. b. Các triệu chứng điển hình, thì: i. FeNO cao làm tăng khả năng hen dị ứng ii. FeNO bình thường hoặc thấp giảm khả năng có mẫn cảm với dị ứng nguyên đang tồn tại trong môi trường sống xung quanh BN. 2. Trên BN đã được chẩn đoán xác định hen chưa kiểm soát do chưa được điều trị corticosteroid hít (hoặc chỉ nhận liều thấp): a. FeNO cao làm tăng khả năng có đáp ứng với corticosteroid (liều khởi đầu hoặc tăng liều) hoặc do nhiều khả năng quản lý tuân thủ điều trị kém. b. FeNO bình thường hoặc thấp không thể loại bỏ việc thử điều trị corticoid hít. 3. Trên BN đã được chẩn đoán xác định hen đang được kiểm soát với ICS: a. FeNO cao ủng hộ việc duy trì tiếp tục liều ICS hiện tại nếu đang ở liều cao hoặc trung bình, nhưng không khuyến khích việc tăng liều trên những BN đang điều trị ICS liều thấp. (Liều ICS gọi là thấp khi tương đương với beclomethasone liều ≤ 200 μg, trung bình khi từ 200 đến 400 μg và cao khi > 400 μg / ngày). b. FeNO trung bình hoặc thấp ủng hộ việc giảm liều ICS trên BN đang điều trị ICS liều cao hoặc không ủng hộ việc tăng liều corticosteroid ở BN đang điều trị ICS liều thấp. 4. Trên BN đã được chẩn đoán xác định hen nhưng vẫn không kiểm soát với ICS liều tối đa, thì FeNO cao làm tăng khả năng có đáp ứng với điều trị anti-IgE. |
* FeNO cao khi > 50 ppb ở người lớn (> 35 ppb ở trẻ em), trung bình khi từ 25 đến 50 ppb ở người lớn (20 – 35 ppb ở trẻ em), và thấp khi < 25 ppb ở người lớn (< 20 ppb ở trẻ em).
Đinh Xuân Anh Tuấn
Bệnh Viện Cochin, Paris và Đại Học Y Khoa Paris Descartes, Pháp
References
1. Pagnier J, Baudin-Creuza V, Marden MC. La désoxygénation du milieu ambiant était-elle la fonction première de l’hémoglobine ? Med Sci (Paris)2000; 16: 961-3.
2. Thébaud B, Arnal JF, Mercier JC, Dinh-Xuan AT. Inhaled and exhaled nitric oxide. Cell Mol Life Sci 1999; 55: 1103-12.
3. Gustafsson LE, Leone AM, Persson MG, Wiklund NP, Moncada S. Endogenous nitric oxide is present in the exhaled air of rabbits, guinea pigs and humans. Biochem Biophys Res Commun 1991; 181: 852-7.
4. Delclaux C, Dinh-Xuan AT. Art – et artefacts – de la mesure du NO expiré dans l’asthme. Rev Mal Respir 2005; 22: 209-11.
5. Dinh-Xuan AT, Texereau J. Measuring exhaled NO: not only a matter of how – but also why – should we do it? Eur Respir J 1998; 12: 1005-7.
6. http://www.ncbi.nlm.nih.gov/pubmed?term=exhaled%20nitric%20oxide (xem ngày 31/8/2016)
7. http://www.ncbi.nlm.nih.gov/pubmed?term=exhaled%20nitric%20oxide%20asthma (xem ngày 31/8/2016)
8. Kharitonov S, Alving K, Barnes PJ. Exhaled and nasal nitric oxide measurements: recommendations. The European Respiratory Society Task Force. Eur Respir J 1997; 10: 1683-93.
9. American Thoracic Society; European Respiratory Society. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide, 2005. Am J Respir Crit Care Med 2005; 171: 912-30.
10. Dweik RA, Boggs PB, Erzurum SC, Irvin CG, Leigh MW, Lundberg JO, Olin AC, Plummer AL, Taylor DR; American Thoracic Society Committee on Interpretation of Exhaled Nitric Oxide Levels (FENO) for Clinical Applications. An official ATS clinical practice guideline: interpretation of exhaled nitric oxide levels (FENO) for clinical applications. Am J Respir Crit Care Med 2011; 184:602-15.
11. de Winter-de Groot KM, van der Ent CK. Nitric oxide in cystic fibrosis. J Cyst Fibros 2005; 4 (Suppl 2): 25-9.
12. Walker WT, Jackson CL, Lackie PM, Hogg C, Lucas JS. Nitric oxide in primary ciliary dyskinesia. Eur Respir J 2012; 40: 1024-32.
13. Tiev KP, Cabane J, Aubourg F, Kettaneh A, Ziani M, Mouthon L, Duong-Quy S, Fajac I, Guillevin L, Dinh-Xuan AT. Severity of scleroderma lung disease is related to alveolar concentration of nitric oxide. Eur Respir J 2007; 30: 26-30.
14. Tiev KP, Hua-Huy T, Kettaneh A, Allanore Y, Le-Dong NN, Duong-Quy S, Cabane J, Dinh-Xuan AT. Alveolar concentration of nitric oxide predicts pulmonary function deterioration in scleroderma. Thorax 2012; 67: 157-63.
15. Moncada S, Higgs EA. The L-arginine–nitric oxide pathway. N Engl J Med 1993; 329: 2002-12.
16. Ricciardolo FL, Sterk PJ, Gaston B, Folkerts G. Nitric oxide in health and disease of the respiratory system. Physiol Rev 2004; 84: 731-65.
17. Dinh-Xuan AT. Rôle du monoxyde d'azote en physiologie respiratoire et dans la physiopathologie des maladies pulmonaires. Rev Mal Respir 1996; 13: 381-8.
18. Mahut B, Louis B, Delclaux C. Mesure du NO expiré : méthodologie. Rev Mal Respir 2006; 23: 6S29-36.
19. Silkoff PE, McClean PA, Slutsky AS, Furlott HG, Hoffstein E, Wakita S, Chapman KR, Szalai JP, Zamel N. Marked flow-dependence of exhaled nitric oxide using a new technique to exclude nasal nitric oxide. Am J Respir Crit Care Med 1997; 155: 260-7.
20. George SC, Hogman M, Permutt S, Silkoff PE. Modeling pulmonary nitric oxide exchange. J Appl Physiol 2004; 96:831-9.
21. Mahut B, Louis B, Zerah-Lancner F, Delclaux C. Validity criteria and comparison of analytical methods of flow-independent exhaled NO parameters. Respir Physiol Neurobiol 2006; 153: 148-56.
22. Delclaux C, Mahut B, Zerah-Lancner F, Delacourt C, Laoud S, Cherqui D, Duvoux C, Mallat A, Harf A. Increased nitric oxide output from alveolar origin during liver cirrhosis versus bronchial source during asthma. Am J Respir Crit Care Med 2002; 165: 332-7.
23. Lehtimaki L, Kankaanranta H, Saarelainen S, Hahtola P, Jarvenpaa R, Koivula T, Turjanmaa V, Moilanen E. Extended exhaled NO measurement differentiates between alveolar and bronchial inflammation. Am J Respir Crit Care Med 2001; 163: 1557-61.
24. Tsoukias NM, George SC. A two-compartment model of pulmonary nitric oxide exchange dynamics. J Appl Physiol 1998; 85: 653-66.
25. Tsoukias NM, Tannous Z, Wilson AF, George SC. Single-exhalation profiles of NO and CO2 in humans: effect of dynamically changing flow rate. J Appl Physiol 1998; 85: 642-52.
26. Högman M, Malinovschi A, Norback D, Janson C. Added value with extended NO analysis in atopy and asthma. Clin Physiol Funct Imaging 2011; 31: 294-9.
27. Mahut B, Delclaux C, Tillie-Leblond I, Gosset P, Delacourt C, Zerah-Lancner F, Harf A, de Blic J. Both inflammation and remodeling influence nitric oxide output in children with refractory asthma. J Allergy Clin Immunol 2004; 113: 252-6.
28. Payne DN, Adcock IM, Wilson NM, Oates T, Scallan M, Bush A. Relationship between exhaled nitric oxide and mucosal eosinophilic inflammation in children with difficult asthma, after treatment with oral prednisolone. Am J Respir Crit Care Med 2001; 164: 1376-81.
29. Mahut B, Trinquart L, Le Bourgeois M, Becquemin MH, Beydon N, Aubourg F, Jala M, Bidaud-Chevalier B, Dinh-Xuan AT, Randrianarivelo O, Denjean A, de Blic J, Delclaux C. Multicentre trial evaluating alveolar NO fraction as a marker of asthma control and severity. Allergy 2010; 65: 636-44
30. Recommendations for standardized procedures for the on-line and off-line measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide in adults and children-1999. This official statement of the American Thoracic Society was adopted by the ATS Board of Directors, July 1999. Am J Respir Crit Care Med 1999; 160: 2104-17.
31. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide, 2005. Am J Respir Crit Care Med 2005; 171: 912-30.
32. Baraldi E, de Jongste JC. Measurement of exhaled nitric oxide in children, 2001. Eur Respir J 2002; 20: 223-37.
33. Kharitonov S, Alving K, Barnes PJ. Exhaled and nasal nitric oxide measurements: recommendations. The European Respiratory Society Task Force. Eur Respir J 1997; 10: 1683-93.
34. Buchvald F, Baraldi E, Carraro S, Gaston B, De Jongste J, Pijnenburg MW, Silkoff PE, Bisgaard H. Measurements of exhaled nitric oxide in healthy subjects age 4 to 17 years. J Allergy Clin Immunol 2005; 115: 1130-6.
35. Warke TJ, Fitch PS, Brown V, Taylor R, Lyons JD, Ennis M, Shields MD. Exhaled nitric oxide correlates with airway eosinophils in childhood asthma. Thorax 2002; 57: 383-7.
36. Silkoff PE, Lent AM, Busacker AA, Katial RK, Balzar S, Strand M, Wenzel SE. Exhaled nitric oxide identifies the persistent eosinophilic phenotype in severe refractory asthma. J Allergy Clin Immunol 2005; 116: 1249-55.
37. Smith AD, Cowan JO, Filsell S, McLachlan C, Monti-Sheehan G, Jackson P, Taylor DR. Diagnosing asthma: comparisons between exhaled nitric oxide measurements and conventional tests. Am J Respir Crit Care Med 2004; 169: 473-8.
38. Chatkin JM, Ansarin K, Silkoff PE, McClean P, Gutierrez C, Zamel N, Chapman KR. Exhaled nitric oxide as a noninvasive assessment of chronic cough. Am J Respir Crit Care Med 1999; 159: 1810-3.
39. Kowal K, Bodzenta-Lukaszyk A, Zukowski S. Exhaled nitric oxide in evaluation of young adults with chronic cough. J Asthma 2009; 46: 692-8.
40. Oh MJ, Lee JY, Lee BJ, Choi DC. Exhaled nitric oxide measurement is useful for the exclusion of nonasthmatic eosinophilic bronchitis in patients with chronic cough. Chest 2008; 134: 990-5.
41.Smith AD, Cowan JO, Brassett KP, Filsell S, McLachlan C, Monti-Sheehan G Herbison GP, Taylor DR. Exhaled nitric oxide: a predictor of steroid response. Am J Respir Crit Care Med 2005; 172: 453-9.
42. Hahn PY, Morgenthaler TY, Lim KG. Use of exhaled nitric oxide in predicting response to inhaled corticosteroids for chronic cough. Mayo Clin Proc 2007; 82: 1350-5.
43. Pérez-de-Llano LA, Carballada F, Castro Añón O, Pizarro M, Golpe R, Baloira A, Vázquez Caruncho M, Boquete M. Exhaled nitric oxide predicts control in patients with difficult-to-treat asthma. Eur Respir J 2010; 35: 1221-7.
44. Berkman N, Avital A, Breuer R, Bardach E, Springer C, Godfrey S. Exhaled nitric oxide in the diagnosis of asthma: comparison with bronchial provocation tests. Thorax 2005; 60: 383-8.
45. Cowan DC, Cowan JO, Palmay R, Williamson A, Taylor DR. Effects of steroid therapy on inflammatory cell subtypes in asthma. Thorax 2010; 65: 384-90.
46. GINA. 2014. Global strategy for asthma management and prevention. Global Initiative for Asthma. http://www.ginasthma.org. (consulté le 16 juillet 2014)
47. Ozier A, Girodet PO, Bara I, Tunon de Lara JM, Marthan R, Berger P. Control maintenance can be predicted by exhaled NO monitoring in asthmatic patients. Respir Med 2011; 105: 989-96.
48. Michils A, Baldassarre S, Van Muylem A. Exhaled nitric oxide and asthma control: a longitudinal study in unselected patients. Eur Respir J 2008; 31: 539-46.
49. Papaioannou AI, Minas M, Tanou K, Gourgoulianis KI, Kostikas K. Exhaled NO may predict loss of asthma control: the effect of concomitant allergic rhinitis. Eur Respir J 2009; 34: 1006-7.
50. Pijnenburg MW, Hofhuis W, Hop WC, de Jongste JC. Exhaled nitric oxide predicts asthma relapse in children with clinical asthma remission. Thorax 2005; 60: 215-8.
51. Smith AD, Cowan JO, Brassett KP, Herbison GP, Taylor DR. Use of exhaled nitric oxide measurements to guide treatment in chronic asthma. N Engl J Med 2005; 352: 2163-73.
52. Shaw DE, Berry MA, Thomas M, Green RH, Brihtling CE, Wardlaw AJ, Pavord ID. The use of exhaled nitric oxide to guide asthma management: a randomized controlled trial. Am J Respir Crit Care Med 2007; 176: 231-7.
53. Szefler SJ, Mitchell H, Sorkness CA, Gergen PJ, O'Connor GT, Morgan WJ, Kattan M, Pongracic JA, Teach SJ, Bloomberg GR, Eggleston PA, Gruchalla RS, Kercsmar CM, Liu AH, Wildfire JJ, Curry MD, Busse WW. Management of asthma based on exhaled nitric oxide in addition to guideline-based treatment for inner-city adolescents and young adults: a randomised controlled trial. Lancet 2008; 372: 1065-72.
54. Pijnenburg MW, Bakker EM, Hop WC, de Jongste JC. Titrating steroids on exhaled nitric oxide in children with asthma: a randomized controlled trial. Am J Respir Crit Care Med 2005; 172: 831-6.
55. de Jongste JC, Carraro S, Hop WC, Baraldi E. Daily telemonitoring of exhaled nitric oxide and symptoms in the treatment of childhood asthma. Am J Respir Crit Care Med 2009; 179: 93-7.
56. Powell H, Murphy VE, Taylor DR, Hensley MJ, McCaffery K, Giles W, Clifton VL, Gibson PG. Management of asthma in pregnancy guided by measurement of fraction of exhaled nitric oxide: a double-blind, randomised controlled trial. Lancet 2011; 378: 983-90.
57. Calhoun WJ, Ameredes BT, King TS, Icitovic N, Bleecker ER, Castro M, Cherniack RM, Chinchilli VM, Craig T, Denlinger L, DiMango EA, Engle LL, Fahy JV, Grant JA, Israel E, Jarjour N, Kazani SD, Kraft M, Kunselman SJ, Lazarus SC, Lemanske RF, Lugogo N, Martin RJ, Meyers DA, Moore WC, Pascual R, Peters SP, Ramsdell J, Sorkness CA, Sutherland ER, Szefler SJ, Wasserman SI, Walter MJ, Wechsler ME, Boushey HA. Comparison of physician-, biomarker-, and symptom-based strategies for adjustment of inhaled corticosteroid therapy in adults with asthma: the BASALT randomized controlled trial. JAMA 2012; 308: 987-97.
58. Petsky HL, Cates CJ, Lasserson TJ, Li AM, Turner C, Kynaston JA, Chang AB. A systematic review and meta-analysis: tailoring asthma treatment on eosinophilic markers (exhaled nitric oxide or sputum eosinophils). Thorax 2012; 67: 199-208.
59. Donohue JF, Jain N. Exhaled nitric oxide to predict corticosteroid responsiveness and reduce asthma exacerbation rates. Respir Med 2013; 107: 943-52.
60. Robinson DS, Campbell DA, Durham SR, Pfeffer J, Barnes PJ, Chung KF. Systematic assessment of difficult-to-treat asthma. Eur Respir J 2003; 22: 478-83.
61. Williams LK, Pladevall M, Xi H, Peterson EL, Joseph C, Lafata JE, Ownby DR, Johnson CC. Relationship between adherence to inhaled corticosteroids and poor outcomes among adults with asthma. J Allergy Clin Immunol 2004;114: 1288-93.
62. Murphy AC, Proeschal A, Brighling CE, Wardlaw AJ, Pavord I, Bradding P, Green RH. The relationship between clinical outcomes and medication adherence in difficult-to-control asthma. Thorax 2012; 67: 751-3.
63. Beck-Ripp J, Griese M, Arenz S, Köring C, Pasqualoni B, Bufler P. Changes of exhaled nitric oxide during steroid treatment in childhood asthma. EurRespir J 2002; 19: 1015-9.
64. Delgado-Corcoran C; Kissoon N, Murphy SP, Duckworth LJ. Exhaled nitric oxide reflects asthma severity and asthma control. Pediatr Crit Care Med 2004; 5: 48-52.
65. Cano-Garcinuno A, Carvajal-Uruena I, Diaz-Vazquez CA, Dominguez-Aurrecoechea B, Garcia-Merino A, Mola-Caballero de Rodas P, Mora- Gandarillas I. Clinical correlates and determinants of airway inflammation in pediatric asthma. J Investig Allergol Clin Immunol 2010; 20: 303-10.
66. Katsara M, Donnelly D, Iqbal S, Elliott T, Everard ML. Relationship between exhaled nitric oxide levels and compliance with inhaled corticosteroids in asthmatic children. Respir Med 2006; 100: 1512-7.
67. McNicholl DM, Stevenson M, McGarvey LP, Heaney LG. The utility of fractional exhaled nitric oxide suppression in the identification of nonadherence in difficult asthma. Am J Respir Crit Care Med 2012; 186: 1102- 8.
68. Chérot-Kornobis N, Hulo S, de Broucker V, Hassoun S, Lepage N, Edmé JL, Sobaszek A. Induced sputum, exhaled NO and breath condensate in occupational medicine. J Occup Environ Med 2012; 54: 922-7.
69. van der Walt A, Singh T, Baatjies R, Lopata AL, Jeebhay MF. Work-related allergic respiratory disease and asthma in spice mill workers is associated with inhalant chili pepper and garlic exposures. Occup Environ Med 2013; 70: 446-52.
70. Baatjies R, Jeebhay MF. Sensitisation to cereal flour allergens is a major determinant of elevated exhaled nitric oxide in bakers. Occup Environ Med 2013; 70: 310-6.
71. Polychronakis I, Thanasias E, Raulf-Heimsoth M, Merget R. Occupational non-immediate type allergic asthma due to ammonium persulfate. Adv Exp Med Biol 2013; 755: 79-84.
72. Thanasias E, Polychronakis I, van Kampen V, Brüning T, Merget R. Occupational immediate-type allergic asthma due to potassium tetrachloroplatinate in production of cytotoxic drugs. Adv Exp Med Biol 2013; 755: 47-53.
73. Dykewicz MS. Occupational asthma: current concepts in pathogenesis, diagnosis, and management. J Allergy Clin Immunol 2009; 123: 519-28.
74. Sastre J, Carnes J, García del Potro M, Manso L, Aguado E, Fernández-Nieto M. Occupational asthma caused by triglycidyl isocyanurate. Int Arch Occup Environ Health 2011; 84: 547-9.
75. Walters GI, Moore VC, Robertson AS, Burge CB, Vellore AD, Burge PS. An outbreak of occupational asthma due to chromium and cobalt. Occup Med (Lond) 2012; 62: 533-40.
76. Vizcaya D, Mirabelli MC, Orriols R, Antó JM, Barreiro E, Burgos F, Arjona L, Gomez F, Zock JP. Functional and biological characteristics of asthma in cleaning workers. Respir Med 2013; 107: 673-83.
77. Tossa P, Paris C, Zmirou-Navier D, Demange V, Acouetey DS, Michaely JP, Bohadana A. Increase in exhaled nitric oxide is associated with bronchial hyperresponsiveness among apprentices. Am J Respir Crit Care Med 2010; 182: 738-44.
78. Corradi M, Gergelova P, Di Pilato E, Folesani G, Goldoni M, Andreoli R, Selis L, Mutti A. Effect of exposure to detergents and other chemicals on biomarkers of pulmonary response in exhaled breath from hospital cleaners: a pilot study. Int Arch Occup Environ Health 2012; 85: 389-96.
79. Bohadana AB, Hannhart B, Ghezzo H, Teculescu D, Zmirou-Navier D. Exhaled nitric oxide and spirometry in respiratory health surveillance. Occup Med (Lond) 2011; 61: 108-14.
80. Sikkeland LI, Eduard W, Skogstad M, Alexis NE, Kongerud J. Recovery from workplace-induced airway inflammation 1 year after cessation of exposure. Occup Environ Med 2012; 69: 721-6.
81. de Broucker V, Hulo S, Cherot-Kornobis N, Lartigau-Sezary I, Matran R, Sobaszek A, Edme JL. Interest of exhaled biomarkers in occupational asthma to latex: a case report. Arch Environ Occup Health 2012; 67: 170-6.
82. Malo JL, Chan-Yeung Moira, Kennedy S. Occupational agents. In: Barnes PJ, Drazen JM, Rennard SI, Thomson NC. Asthma and COPD. Basic mechanisms and clinical management. Second edition. Academic Press; 2009: 878 p.
83. Moscato G, Pala G, Barnig C, De Blay F, Del Giacco SR, Folletti I, Heffler E, Maestrelli P, Pauli G, Perfetti L, Quirce S, Sastre J, Siracusa A, Walusiak- Skorupa J, van Wjik RG; European Academy of Allergy and Clinical Immunology. EAACI consensus statement for investigation of work-related asthma in non-specialized centres. Allergy 2012; 67: 491-501.
84. Jares EJ, Baena-Cagnani CE, Gómez RM. Diagnosis of occupational asthma: an update. Curr Allergy Asthma Rep 2012; 12: 221-31.
85. Berg J, Lindgren P. Economic evaluation of FENO measurement in diagnosis and 1-year management of asthma in Germany. Respir Med 2008; 102: 219-31.
86. Price D, Berg J, Lindgren P. An economic evaluation of NIOX MINO airway inflammation monitor in the United Kingdom. Allergy 2009; 64: 431-8.
87. Measuring fractional exhaled nitric oxide concentration in asthma: NIOX MINO, NIOX VERO and NObreath. National Institute for Health and Care Excellence (NICE). https://www.nice.org.uk/Guidance/DG12. (consulté le 16 juillet 2014)
88. Hanania NA, Wenzel S, Rosén K, Hsieh HJ, Mosesova S, Choy DF, Lal P, Arron JR, Harris JM, Busse W. Exploring the effects of omalizumab in allergic asthma: an analysis of biomarkers in the EXTRA study. Am J Respir Crit Care Med 2013;187: 804-11
89. Boot JD, de Ridder L, de Kam ML, Calderon C, Mascelli MA, Diamant Z. Comparison of exhaled nitric oxide measurements between NIOX MINO electrochemical and Ecomedics chemiluminescence analyzer. Respir Med 2008; 102: 1667-71.
90. Kalliola S, Malmberg P, Rito T, Pelkonen AS, Mäkelä MJ. Can we use portable nitric oxide analyzer in young children? Pediatr Pulmonol 2011; 46:627-31.
91. Antus B, Horvath I, Barta I. Assessment of exhaled nitric oxide by a new hand- held device. Respir Med 2010; 104: 1377-80.
92. Mandon J, Högman M, Merkus PJ, van Amsterdam J, Harren FJ, Cristescu SM. Exhaled nitric oxide monitoring by quantum cascade laser: comparison with chemiluminescent and electrochemical sensors. J Biomed Opt 2012; 17: 017003.
93. Korn S, Telke I, Kornmann O, Buhl R. Measurement of exhaled nitric oxide: comparison of different analysers. Respirology 2010; 15: 1203-8.
94. Alving K, Janson C, Nordvall L. Performance of a new hand-held device for exhaled nitric oxide measurement in adults and children. Respir Res 2006; 7:67.