- Chi tiết
-
Được đăng: 29 Tháng 2 2016
TÓM TẮT
Hội chứng chồng lấp hen-COPD (ACOS) được đặc trưng bởi giới hạn luồng khí không hồi phục; bệnh nhân vừa có vài triệu chứng của bệnh hen vừa có vài triệu chứng của bệnh COPD. ACOS có thể là một kiểu hình đặc biệt của một nhóm bệnh tắc nghẽn đường thở mạn tính, trong đó hen và COPD là hai thái cực của nhóm bệnh này. Lưu hành độ của ACOS được báo cáo khác nhau do các tác giả áp dụng các tiêu chuẩn khác nhau để chẩn đoán bệnh. Bệnh nhân bị ACOS sử dụng nhiều nguồn lực y tế. Họ có nhiều biến cố bất lợi hơn so với bệnh nhân bị hen hoặc COPD đơn thuần. Chẩn đoán ACOS hiện là một thách thức cho các bác sĩ lâm sàng bởi vì hiện không có các dấu ấn sinh học cụ thể để phân biệt ACOS với hen hoặc COPD. Cách tiếp cận chẩn đoán ACOS tùy thuộc vào tiền căn bệnh lý của bệnh nhân: họ đã được chẩn đoán hen hoặc COPD trước đó hoặc chưa được chẩn đoán bệnh tắc nghẽn đường thở mạn tính. Cá thể hóa điều trị nên được áp dụng cho ACOS để đạt hiệu quả điều trị tối ưu với tác dụng phụ tối thiểu. Trong bài báo này, chúng tôi hệ thống lại các tiêu chuẩn chẩn đoán ACOS được sử dụng trong các nghiên cứu trước đây, gợi ý cách tiếp cận thực tế cho việc chẩn đoán và điều trị ACOS và nêu lên các câu hỏi nghiên cứu liên quan đến ACOS.
Từ khóa: ACOS, hen, bệnh phổi tắc nghẽn mạn tính, bệnh tắc nghẽn đường thở, kiểu hình
Từ viết tắt: COPD, bệnh phổi tắc nghẽn mạn tính; ACOS, hội chứng chồng lấp hen-COPD; DLCO, khả năng khuếch tán khí CO của phổi; FEV1, thể tích thở ra gắng sức trong giây đầu tiên; FVC, dung tích sống gắng sức; GINA, Chiến lược toàn cầu về hen; GOLD, Chiến lược toàn cầu về bệnh phổi tắc nghẽn mạn tính; HRCT, CT độ phân giải cao; ICS, corticosteroid dạnh hít; LABA, thuốc kích thích beta-2 tác dụng kéo dài; LAMA, thuốc đối kháng thụ thể muscarinic tác dụng kéo dài; LTRA, thuốc đối kháng thụ thể leukotriene; PEF: lưu lượng thở ra đỉnh; SABA, thuốc kích thích beta-2 tác dụng ngắn; SAMA, thuốc đối kháng thụ thể muscarinic tác dụng ngắn.
GIỚI THIỆU
Hen và COPD là 2 bệnh phổi mạn tính thường gặp nhất tại các phòng khám hô hấp.1, 2 Chúng có đặc điểm chung là tình trạng viêm mạn tính và tái cấu trúc đường dẫn khí, nhưng chúng khác nhau trong bản chất của hiện tượng viêm, cấu trúc phổi có liên quan, và nơi chủ yếu xảy ra các biến đổi bệnh học.3 Các khác biệt này được thể hiện rõ ràng khi chúng ta so sánh một người trẻ không hút thuốc lá mà bị hen với một người lớn tuổi có hút thuốc là mà bị COPD. Tuy nhiên, thỉnh thoảng chúng ta rất khó mà chẩn đoán phân biệt được hen với COPD, đặc biệt ở người lớn tuổi đã hoặc đang hút thuốc lá.4 Một đề án phối hợp giữa Chiến lược toàn cầu về hen (GINA) và Chiến lược toàn cầu về COPD (GOLD) đã mô tả Hội chứng chồng lấp hen-COPD (ACOS) như sau: “ACOS được đặc trưng bởi giới hạn luồng khí không hồi phục; bệnh nhân vừa có vài triệu chứng của bệnh hen vừa có vài triệu chứng của bệnh COPD. Do đó, ACOS được nhận biết bằng các triệu chứng vừa giống bệnh hen vừa giống bệnh COPD”.4 Mô tả này nghe có vẻ trực quan nhưng rất khó áp dụng vào thực hành lâm sàng hàng ngày.
Vì ACOS có các đặc điểm chồng lấp với hen và COPD,5 ACOS có thể là một kiểu hình đặc biệt của một nhóm bệnh tắc nghẽn đường thở mạn tính, trong đó hen và COPD là hai thái cực của nhóm bệnh này.6, 7 Các yếu tố nguy cơ do di truyền, cơ chế bệnh sinh, biến đổi bệnh học, đặc điểm lâm sàng, đáp ứng điều trị và tiên lượng của ACOS vẫn chưa rõ. Trong bài báo này, chúng tôi hệ thống lại các tiêu chuẩn chẩn đoán ACOS được sử dụng trong các nghiên cứu trước đây, gợi ý cách tiếp cận thực tế cho việc chẩn đoán và điều trị ACOS và nêu lên các câu hỏi nghiên cứu liên quan đến ACOS.
TIÊU CHUẨN CHẨN ĐOÁN VÀ LƯU HÀNH ĐỘ CỦA ACOS
ACOS vẫn chưa được định nghĩa rõ ràng8, 9 và được biết đến với nhiều tên gọi khác nhau, bao gồm hội chứng chồng lấp hen và COPD,10 kiểu hình hỗn hợp hen-COPD,11 hen kết hợp với COPD,12 đồng mắc hen và COPD,13 hoặc COPD có triệu chứng hen.14 Tuy nhiên, ACOS là tên gọi thường được sử dụng nhất.
Khi tổng kết các nghiên cứu trước đây, chúng tôi thấy lưu hành độ của ACOS được báo cáo rất khác nhau bởi vì, tùy thuộc vào thiết kế và dân số nghiên cứu, các tác giả đã sử dụng các tiêu chuẩn khác nhau để chẩn đoán ACOS (Bảng 1).10-13, 15-24 Trong số các bệnh nhân đã được chẩn đoán hen trước đây, bệnh nhân được chẩn đoán mắc bệnh ACOS khi có biểu hiện viêm phế quản mạn tính (ho kéo dài ít nhất 3 tháng trong ít nhất 2 năm) và/hoặc giảm khả năng khuếch tán khí CO của phổi (DLCO), lưu hành độ của ACOS là 29%.23 Trong số các bệnh nhân được chẩn đoán COPD trước đây, bệnh nhân được chẩn đoán ACOS nếu có tiền căn đã từng được bác sĩ chẩn đoán mắc bệnh hen trước 40 tuổi19, lưu hành độ ACOS là 13%; lưu hành độ ACOS tăng lên 55% nếu bệnh nhân có bất kỳ tiêu chuẩn nào của bệnh hen.21 Tùy thuộc vào tiền căn đã từng tiếp xúc với khói thuốc lá hoặc khói chất đốt sinh khối, lưu hành độ của ACOS dao động từ 5% đến 21% khi bệnh nhân thỏa ít nhất 2 tiêu chuẩn chính hoặc một tiêu chuẩn chính và 2 tiêu chuẩn phụ phù hợp hen như được trình bày trong Bảng 1.18 Trong dân số chung, lưu hành độ của ACOS là 1.8% trong nghiên cứu PLATINO tại Châu Mỹ La tinh khi ACOS được chẩn đoán dựa vào triệu chứng lâm sàng và hô hấp ký.22 Tại Hoa Kỳ, lưu hành độ của ACOS là 2.7% khi ACOS được chẩn đoán dựa vào tiền căn đã từng được bác sĩ chẩn đoán từng mắc hen và mắc COPD.12
Bảng 1. Lưu hành độ của ACOS từ các dân số nghiên cứu khác nhau với các tiêu chuẩn chẩn đoán khác nhau
|
Nghiên cứu |
Độ tuổi |
Tiêu chuẩn chẩn đoán |
Lưu hành độ |
|---|---|---|---|
|
Từ dân số là những bệnh nhân được chẩn đoán hen trước đó |
|||
|
Milanese và cs, 201423 |
≥ 65 tuổi |
Từng được bác sĩ chẩn đoán mắc bệnh hen + triệu chứng kinh điển của viêm phế quản mạn và/hoặc DLCO < 80% |
29% |
|
de Marco và cs, 201313 |
2084 tuổi |
Tiền căn từng được bác sĩ chẩn đoán hen + tiền căn từng được bác sĩ chẩn đoán COPD |
1661% |
|
Từ dân số là những bệnh nhân được chẩn đoán COPD trước đó |
|||
|
Golpe và cs, 201418 |
≥ 40 tuổi |
Ít nhất 2 tiêu chuẩn chính hoặc 1 tiêu chuẩn chính kèm 2 tiêu chuẩn phụ. Tiêu chuẩn chính: FEV1 sau GPQ tăng ≥ 15% và ≥ 400 ml so với trước GPQ, FENO > 40 ppb, và có tiền căn hen. Tiêu chuẩn phụ: tăng IgE huyết thanh, tiền căn dị ứng, và FEV1 sau GPQ tăng ≥ 12% và ≥ 200 ml so với trước GPQ ở ít nhất 2 lần thử. |
5.0% nếu tiếp xúc khói thuốc lá; 21.3% nếu tiếp xúc khói chất đốt sinh khối |
|
Miravitlles và cs, 201424 |
≥ 40 tuổi |
Tương tự Golpe và cs ngoại trừ “FENO > 40 ppb” được thay bằng “tăng bạch cầu ái toan trong đàm”. |
6.5% |
|
Kitaguchi và cs, 201220 |
71 ± 1 tuổi |
COPD giai đoạn 2-4 (post-BD FEV1/FVC < 0.70 và FEV1 < 80%) + từng có triệu chứng giống hen (những đợt khó thở, khò khè, ho, và nặng ngực thường nặng lên vào ban đêm hoặc gần sáng) |
27% |
|
Hardin và cs, 201119 |
4580 tuổi |
COPD giai đoạn 2-4 (post-BD FEV1/FVC < 0.70 và FEV1 < 80%) + tiền căn từng được bác sĩ chẩn đoán hen trước 40 tuổi |
13% |
|
Marsh và cs, 200821 |
> 50 tuổi |
COPD (post-BD FEV1/FVC < 0.70) + bất kỳ tiêu chuẩn nào phù hợp hen (FEV1 sau GPQ tăng ≥ 15%, PEF dao động > 20% trong 1 tuần theo dõi, và được bác sĩ chẩn đoán hen do có triệu chứng phù hợp hoặc từng sử dụng thuốc dạng hít trong 12 tháng qua) |
55% |
|
Từ dân số là những bệnh nhân được chẩn đoán hoặc hen hoặc COPD |
|||
|
Fu và cs, 201417 |
> 55 tuổi |
Triệu chứng hô hấp phù hợp + nghiệm pháp kích thích phế quản dương tính và/hoặc nghiệm pháp giãn phế quản dương tính + post-BD FEV1/FVC < 70% và post-BD FEV1 < 80% |
56% |
|
Andersen và cs, 201315 |
> 34 tuổi |
Từng điều trị hen + từng điều trị COPD trong quá trình theo dõi |
16.1% |
|
Kauppi và cs, 201110 |
1885 tuổi |
COPD (post-BD FEV1/FVC < 0.70 hoặc post-BD FEV1/FVC < 88% GTDĐ) + bất kỳ tiêu chuẩn nào phù hợp hen (FEV1 sau GPQ tăng ≥ 12%, PEF sau GPQ tăng ≥ 15% hoặc PEF dao động trong ngày ≥ 20%, và FEV1 giảm ≥ 15% khi làm nghiệm pháp gắng sức) |
14.6% |
|
Từ dân số chung |
|||
|
Menezes và cs, 201422 |
> 40 tuổi |
COPD (post-BD FEV1/FVC < 0.70) + tiêu chuẩn chẩn đoán hen (khò khè trong 12 tháng qua + FEV1 hoặc FVC sau giãn phế quản tăng ≥ 200 mL và ≥ 12%) |
1.8% |
|
Chung và cs, 201416 |
> 19 tuổi |
FEV1/FVC < 0.70 + tiền căn có khò khè hoặc thở huýt sáo trong 12 tháng qua |
2.3% |
|
Diaz-Guzman và cs, 201112 |
≥ 25 tuổi |
Trả lời CÓ cho cả 2 câu hỏi sau: “Có bao giờ bác sĩ nói rằng bạn bị bệnh hen?” và “Có bao giờ bác sĩ nói rằng bạn bị bệnh viêm phế quản mạn tính hoặc khí phế thũng phổi?” |
2.7% |
COPD, bệnh phổi tắc nghẽn mạn tính; ACOS, hội chứng chồng lấp hen-COPD; DLCO, khả năng khuếch tán khí CO của phổi; FENO, nồng độ NO trong khí thở ra; FVC, dung tích sống gắng sức; FEV1, thể tích khí thở ra gắng sức trong 1 giây đầu tiên; PEF, lưu lượng thở ra đỉnh; post-BD, sau giãn phế quản.
GÁNH NẶNG BỆNH TẬT CỦA ACOS
Gánh nặng kinh tế
Bệnh nhân ACOS sử dụng một tỉ lệ lớn nguồng lực y tế có sẵn. Họ bị nhập viện thường xuyên hơn bệnh nhân hen hoặc COPD đơn thuần,15 từ đó dẫn đến chi phí y tế cao hơn do chi phí nhập viện chiếm phần lớn nhất trong tổng chi phí y tế ở bệnh nhân COPD.25 Một nghiên cứu hồi cứu đã chỉ ra rằng bệnh nhân ACOS chịu chi phí y tế cao hơn vì họ sử dụng nhiều dịch vụ chăm sóc y tế hơn bệnh nhân COPD đơn thuần.26 Một nghiên cứu gần đây, sử dụng dữ liệu năm 2009 của Cơ Quan Bảo Hiểm Quốc Gia Hàn Quốc, cho thấy rằng tỉ lệ khám cấp cứu hoặc nhập viện hoặc nhập khoa hồi sức cao hơn ở bệnh nhân ACOS so với bệnh nhân COPD đơn thuần.27 Trong số những người sử dụng bảo hiểm y tế Medicaid của Hoa Kỳ, bệnh nhân ACOS sử dụng nhiều hơn ở bất kỳ dịch vụ y tế nào (khám phòng mạch, dịch vụ nội hoặc ngoại trú) so với bệnh nhân hen hoặc COPD đơn thuần. Trong nghiên cứu này, bệnh nhân được phân loại ACOS nếu họ đã từng ít nhất một lần nhận thuốc điều trị COPD và ít nhất một lần nhận thuốc điều trị hen,28 chi phí y tế hàng năm trung bình ở bệnh nhân ACOS ($14,914) cao hơn so với bệnh nhân hen ($2,307) hoặc COPD ($4,879).28
Gánh nặng bệnh tật
Vì ACOS thường gặp ở người lớn tuổi, bệnh nhân ACOS thường có nhiều vấn đề làm ảnh hưởng xấu đến sức khỏe của họ.29 Bệnh nhân ACOS thường khó thở nhiều hơn, khò khè nhiều hơn, có nhiều đợt kịch phát hơn, có chất lượng sống liên quan đến hô hấp thấp hơn và có mức độ hoạt động thể lực thấp hơn bệnh nhân COPD đơn thuần.16, 30, 31 Một nghiên cứu đa trung tâm cho thấy rằng bệnh nhân COPD có cơ địa dị ứng, một đặc điểm của ACOS, hay bị ho mạn tính và khạc đàm hơn bệnh nhân COPD không có cơ địa dị ứng.32 Một nghiên cứu quan sát khác cho thấy rằng bệnh nhân ACOS có mức độ khó thở mMRC (modified Medical Research Council) (1.26 ± 0.98 so với 0.99 ± 0.88, P = 0.01) cao hơn và tỉ lệ có ít nhất một đợt kịch phát nặng trong năm qua (42% so với 18%, P < 0.01) cao hơn bệnh nhân hen đơn thuần.23
Tỷ lệ tử vong
Kết quả các nghiên cứu liên quan đến tỉ lệ tử vong do ACOS thì không thống nhất. Trong một nghiên cứu theo dõi dọc 4 năm, tỉ lệ tử vong không khác nhau giữa bệnh nhân ACOS, hen và COPD (P = 0.320).17 Tuy nhiên, nghiên cứu này có nhược điểm là cở mẫu nhỏ và chỉ được theo dõi trong thời gian tương đối ngắn. Trong một nghiên cứu theo dõi dọc khác qua 18 năm, bệnh nhân ACOS có nguy cơ tử vong cao nhất với tỉ số nguy cơ (hazard ratio-HR) là 1,83 (KTC 95%: 1,34—2,49), tiếp đến là COPD đơn thuần (HR 1,44, KTC 95%: 1,28—1,62) và cuối cùng là hen đơn thuần (HR 1,16, KTC 95%: 0,94—1,42) khi so với bệnh nhân không mắc bệnh tắc nghẽn đường thở mạn tính. Mức độ khác biệt này giảm xuống sau khi hiệu chỉnh cho chức năng phổi ban đầu, nhưng bệnh nhân ACOS vẫn có nguy cơ tử vong cao nhất (HR 1,45, KTC 95%: 1,06—1,98), tiếp đến là COPD đơn thuần (HR 1,28, KTC 95%: 1,13—1,45) và cuối cùng là hen đơn thuần (HR 1,04, KTC 95%: 0,85—1.27).12
SINH BỆNH HỌC ACOS
Có sự chồng lấp về di truyền, mô bệnh học và rối loạn chức năng giữa hen và COPD.3, 33 ACOS dường như là trường hợp đặc biệt bắt nguồn từ sự tương tác của những rối loạn về di truyền, mô bệnh học và chức năng trong hen hoặc COPD.
Christenson và cộng sự, bằng cách dùng các bộ dữ liệu hen và COPD, cho thấy rằng dâu ấn các gene liên quan đến hen tăng lên rõ rệt ở bệnh nhân COPD không có tiền căn hen nhưng có các triệu chứng giống hen.33
Về mô bệnh học, những biến đổi cấu trúc trong đường dẫn khí nhỏ góp phần gây ra kiểu hình chồng lấp giữa hen và COPD.34 Hen và COPD có các biểu hiện chung tại lớp biểu mô: tăng sản tế bào đài (goblet cell) và tăng sản tế bào gai (squamous cell). Tại lớp màng nền (the reticular basement membrane), bệnh nhân COPD có triệu chứng giống hen có lớp màn nền dầy hơn bệnh nhân COPD không có triệu chứng giống hen. Khối lượng cơ trơn phế quản tăng lên trong COPD, nhưng không nổi bật bằng trong hen.34 Những biến đổi cấu trúc này có thể biểu hiện trên CT lồng ngực độ phân giải cao (HRCT). Bệnh nhân ACOS có ứ khí nhiều hơn trên CT chụp ở thì thở ra,19 có mức độ khí phế thũng nhẹ hơn và có thành phế quản dầy hơn trên CT chụp ở thì hít vào hơn bệnh nhân COPD đơn thuần.30
Về lâm sàng, ACOS có các yếu tố nguy cơ chính giống với hen và COPD. Tăng đáp ứng phế quản, một đặc điểm của hen, được xem như là một yếu tố nguy cơ gây COPD bên cạnh tuổi già và hít khí độc hại.35-37 Ở người lớn, tiền căn hen và tiếp xúc mạn tính với khói thuốc lá hoặc khói chất đốt sinh khối có thể tương tác với nhau để tăng nguy cơ tắc nghẽn đường dẫn khí không hồi phục,38-40 một đặc điểm quan trọng của ACOS. Hút thuốc lá có thể làm thay đổi kiểu viêm đường thở trong hen từ tăng bạch cầu ái toan thành tăng bạch cầu đa nhân trung tính với số lượng tế bào CD8+ tăng, do đó trở thành kiểu viêm thường thấy trong COPD.41 Bệnh nhân hen có hút thuốc lá có số lượng tế bào đài nhiều hơn, số lượng dưỡng bào nhiều hơn, số lượng bạch cầu ái toan ít hơn và lớp biểu mô dầy hơn bệnh nhân hen chưa bao giờ hút thuốc lá.42 ACOS trở nên phổ biến hơn ở người lớn tuổi.13, 26, 27 Điều này có thể do người lớn tuổi có thời gian tiếp xúc với dị nguyên dài hơn, hoặc tiếp xúc kéo dài với các kích thích trong môi trường như ô nhiễm không khí và hút thuốc lá thụ động, hoặc do có những biến đổi sinh lý học trong phổi liên quan đến tuổi già.43
CHẨN ĐOÁN ACOS THEO CÁCH TIẾP CẬN BẬC THANG
Bệnh nhân ACOS thường được chẩn đoán lúc 40 tuổi hoặc hơn.44 Triệu chứng của họ, như ho có đàm, khò khè và khó thở, thường dai dẵng nhưng có thể thay đổi theo thời gian. Khi điều trị bằng thuốc giãn phế quản và/hoặc corticosteroids hít (ICS), các triệu chứng này thường giảm một phần, nhưng đáng kể.4 Bệnh nhân ACOS thường có giới hạn luồng khí thở dai dẵng nhưng dao động một cách tự nhiên hoặc do điều trị.4
Chẩn đoán ACOS là một thách thức vì hiện chưa có các dấu ấn sinh học cụ thể để phân biệt ACOS với hen và COPD.45 Vì một yếu tố đơn thuần, như triệu chứng hô hấp hoặc kết quả hô hấp ký, không đủ để phân biệt giữa hen, COPD và ACOS,5 đặc biệt ở người lớn tuổi46 và ở người đã hoặc đang hút thuốc lá,47 các tiêu chuẩn chính và phụ đã được đề xuất để chẩn đoán ACOS.18, 24 Tuy nhiên, các tiêu chuẩn này vẫn không chắc chắn và bác sĩ thường thay đổi chẩn đoán trong quá trình theo dõi bệnh nhân. Trong lâm sàng bác sĩ có thể gặp phải thách thức chẩn đoán ACOS ở 2 nhóm bệnh nhân sau: bệnh nhân hen có tắc nghẽn đường dẫn khí không hồi phục và bệnh nhân COPD có tiền căn hen. Chúng tôi đề xuất cách tiếp cận thực tế cho 2 nhóm bệnh nhân đó như sau:
Bệnh nhân được chẩn đoán hen trước đó
ACOS nên được xem xét ở bệnh nhân hen có các yếu tố nguy cơ gây giới hạn luồng khí thở dai dẵng (tắc nghẽn đường dẫn khí cố định): hen khởi phát lúc nhỏ với tình trạng khò khè trường diễn từ những năm đầu đời cho tới tuổi trưởng thành,35 hen kéo dài nhưng không được điều trị bằng ICS,48 hen khởi phát ở tuổi trưởng thành,49 và hen nặng hoặc hen khó trị.50
Cách tiếp cận bậc thang có thể áp dụng để chẩn đoán ACOS ở bệnh nhân hen có tắc nghẽn đường dẫn khí cố định (Hình 1). Chúng tôi đề xuất rằng, tất cả bệnh nhân hen có hội chứng tắc nghẽn nên được điều trị thử trong 3‒6 tháng bằng ICS liều cao kết hợp với thuốc dãn phế quản tác dụng dài (LABA) và kèm các thuốc khác để tối ưu hóa chức năng phổi và để loại trừ hội chứng tắc nghẽn có hồi phục.1 Thuốc kết hợp ICS/LABA có thể chỉ định cho bệnh nhân chưa bao giờ dùng ICS. Bệnh nhân đã từng dùng ICS hoặc thuốc kết hợp ICS/LABA ít nhất 3 tháng trước khi khám bệnh có thể xem xét dùng kèm các thuốc khác như thuốc đối kháng thụ thể muscarinic tác dụng dài (LAMA);51 thuốc kháng thụ thể leukotriene (LTRA);52, 53 hoặc thuốc kết hợp kích thích beta-2 tác dụng ngắn (SABA) và kháng thụ thể muscarinic tác dụng ngắng (SAMA) kèm theophylline phóng thích chậm nếu không có LAMA.1 Trong quá trình theo dõi, bệnh nhân nên được đánh giá để bảo đảm rằng họ tuân thủ điều trị trước khi lặp lại hô hấp ký có thử thuốc giãn phế quản. ACOS là một chẩn đoán có thể nếu tắc nghẽn đường dẫn khí vẫn không hồi phục sau quá trình điều trị thử. Chúng tôi công nhận rằng các thuốc và thời gian điều trị thử được khuyến cáo như trên là còn bàn cải và nên được kiểm chứng trong các nghiên cứu tương lai.
Chẩn đoán ACOS được chấp nhận nếu bệnh nhân có tiền căn hít khí độc hại8 và/ hoặc có dấu hiệu khí phế thũng trên HRCT hoặc có DLCO giảm.43 Hiện vẫn chưa rõ là bệnh nhân hen có hội chứng tắc nghẽn cố định nên được phân loại là hen hay là ACOS. Theo quan điểm chúng tôi, bệnh nhân hen có hội chứng tắc nghẽn cố định nên được phân loại là ACOS nếu họ đã từng phơi nhiễm với khí độc hại như khói thuốc lá hoặc khói chất đốt sinh khối. Nếu không tiếp xúc khí độc hại trước đó, họ nên được phân loại là hen. Việc hỏi kỹ tiền căn tiếp xúc khí độc hại là rất quan trọng. Ví dụ, phụ nữ Á châu bị hen dai dẵng nên được khai thác tiền căn hít khói thuốc lá thụ động. Nam không hút thuốc lá nhưng bị hen dai dẵng nên được khai thác tiền căn tiếp xúc với bụi hoặc hóa chất nghề nghiệp. HRCT và DLCO có thể giúp chẩn đoán phân biệt ACOS với hen. Tuy nhiên, giá trị ngưỡng của mức độ khí phế thũng trên HRCT hoặc của DLCO để chẩn đoán phân biệt 2 bệnh này vẫn chưa được thiết lặp.
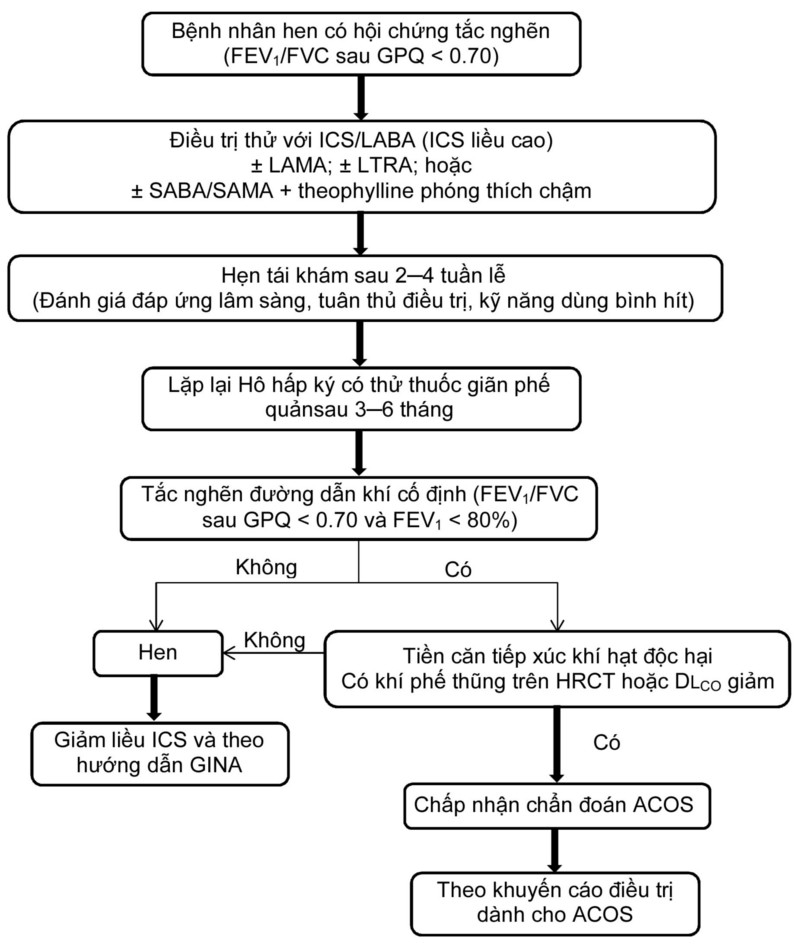
Hình 1. Lưu đồ chẩn đoán ACOS ở bệnh nhân được chẩn đoán hen trước đó.
FEV1, thể tích thở ra gắng sức trong giây đầu tiên; FVC, dung tích sống gắng sức; ICS, corticosteroid dạnh hít; LABA, thuốc kích thích beta-2 tác dụng kéo dài; LAMA, thuốc đối kháng thụ thể muscarinic tác dụng kéo dài; LTRA, thuốc đối kháng thụ thể leukotriene; SABA, thuốc kích thích beta-2 tác dụng ngắn; SAMA, thuốc đối kháng thụ thể muscarinic tác dụng ngắn; HRCT, CT độ phân giải cao; DLCO, khả năng khuếch tán khí CO của phổi; GINA, Chiến lược toàn cầu về hen.
Bệnh nhân được chẩn đoán COPD trước đó
Bác sĩ có khuynh hướng gán bệnh nhân hen có hội chứng tắc nghẽn cố định cho COPD hơn là gán bệnh nhân COPD có hội chứng tắc nghẽn hồi phục một phần cho hen.54 Do đó, một bộ phận bệnh nhân được chẩn đoán COPD trước đó thực ra là hen hoặc ACOS; những bệnh nhân này nên được nhận dạng bởi vì chúng có các điều trị đặc hiệu khác nhau.55 Việc sử dụng những đặc điểm sau để chẩn đoán phân biệt ACOS với COPD đã được xem xét.
Tiền căn được bác sĩ chẩn đoán hen trước 40 tuổi đã được đề xuất để chẩn ACOS trong số những bệnh nhân COPD.19 Tuy nhiên, tiền căn này do bệnh nhân cung cấp có thể không đáng tin cậy ở các bệnh nhân ≥ 40 tuổi tại các cơ sở y tế tuyến đầu vì sai lệch nhớ lại hoặc không được xác định bằng đo chức năng hô hấp.56 Hơn nữa, tiền căn bị hen có thể không đủ để phân biệt ACOS với COPD bởi vì không phải tất cả bệnh nhân hen đều có triệu chứng hen điển hình và đều đáp ứng với ICS—nghĩa là không phải tất cả bệnh nhân hen đã từng được chẩn đoán xác định hen.9 Bác sĩ có thể cần phải hỏi ba mẹ bệnh nhân về tiền căn hen lúc nhỏ của bệnh nhân vì gần phân nửa bệnh nhân hen lúc nhỏ không biết mình bị hen từ nhỏ.57 Hỏi bệnh sử cẩn thận để nhận biết bệnh nhân từng có triệu chứng hen có thể giúp khẳng định tiền căn bị hen trước 40 tuổi.
Hô hấp ký có thử thuốc giãn phế quản nên được thực hiện thường quy vì test giãn phế quản dương tính là một trong những tiêu chuẩn để phân biệt ACOS với COPD.4 Tuy nhiên, cần cẩn thận khi phân tích kết quả test giãn phế quản ở bệnh nhân COPD vì tỉ lệ có test dương tính dao động tùy theo tiêu chuẩn như thế nào là test dương tính; một số bệnh nhân COPD có thể có chức năng phổi hồi phục đáng kể nếu dùng các thuốc giãn phế quản tác dụng nhanh.58
Số lượng bạch cầu ái toan trong đàm kích thích có thể hữu ích trong việc phân biệt ACOS với COPD. Bệnh nhân ACOS có số lượng bạch cầu ái toan trong đàm nhiều hơn bệnh nhân COPD đơn thuần.20, 59 Tuy nhiên, chỉ có một số ít bệnh viện làm được xét nghiệm đếm tế bào bạch cầu ái toan trong đàm và số lượng bạch cầu ái toan trong đàm của một bệnh nhân nhất định có thể không ổn định theo thời gian.60
KHUYẾN CÁO CHO ĐIỀU TRỊ ACOS
Điều trị chung
Vì bệnh nhân ACOS thường bị loại khỏi các thử nghiệm lâm sàng ngẫu nhiên có đối chứng cho hoặc hen hoặc COPD, đáp ứng của ACOS với điều trị vẫn chưa được biết nhiều.61 Về nguyên tắc, mục tiêu điều trị của ACOS cũng tương tự như của hen và COPD:62 kiểm soát và làm giảm triệu chứng, giảm số đợt kịch phát, giảm tốc độ sụt giảm chức năng phổi và hạn chế tác dụng phụ của thuốc điều trị.63 Điều trị có thể bao gồm các thành phần sau: giáo dục bệnh nhân, cai thuốc lá, tránh dị nguyên, chủng ngừa cúm, vật lý trị liệu phục hồi chức năng hô hấp và điều trị bệnh đồng mắc.64-66
Bệnh nhân ACOS có thể cải thiện với liệu pháp phối hợp ICS/LABA.67, 68 Một nghiên cứu theo dõi dọc trong cộng đồng cho thấy rằng, ở bệnh nhân COPD trên 65 tuổi có bệnh hen đi kèm, chiếm 28% trong toàn bộ bệnh nhân COPD, liệu pháp kết hợp ICS/LABA làm giảm một cách có ý nghĩa thống kê kết cục chung bao gồm tử vong do mọi nguyên nhân và nhập viện do COPD so với dùng LABA đơn thuần (HR 0,84, KTC 95%: 0,77—0,91).69 Tuy nhiên, lợi ích của ICS/LABA trong ACOS nên được kiểm chứng trong các thử nghiệm lâm sàng ngẫu nhiên có nhóm chứng.
LAMA nên được xem xét dùng ở bệnh nhân ACOS có khó thở đáng kể (mMRC > 1). Một thử nghiệm ngẫu nhiên có nhóm chứng kéo dài 12 tuần cho thấy rằng thêm tiotropium 18 g một lần trong ngày vào ICS dường như có hiệu quả ở bệnh nhân COPD kèm hen (hoặc ACOS).70 Tỉ lệ bệnh nhân có đợt kịch phát ở nhóm tiotropium (5.7%) thấp hơn so với nhóm giả dược (10.7%). Một thử nghiệm hoán chuyển nhóm can thiệp khác ở bệnh nhân hen chưa được kiểm soát tốt bằng một ICS cho thấy thêm tiotropium thì hiệu quả hơn so với tăng liều thuốc ICS và không kém hiệu quả hơn so với thêm salmeterol khi đánh giá tất cả các kết cục, như là PEF sáng sớm và chiều tối, FEV1 trước giãn phế quản và số ngày hen được kiểm soát tốt.71
Cá thể hóa điều trị
Để tối ưu hóa kết cục điều trị, mỗi bệnh nhân có thể cần được đánh giá thêm để tìm các đặc điểm phù hợp cho các can thiệp cụ thể. Cách tiếp cận này phù hợp với xu hướng hiện thời: trong cùng một bệnh, nên nhận dạng một nhóm bệnh nhân có cùng đặc điểm lâm sàng, dự hậu, và quan trọng hơn, có đáp ứng tương tự nhau với các điều trị hiện có.72
Một ví dụ của cá thể hóa điều trị là ICS có thể xem xét dùng ở bệnh nhân ACOS có tăng đáng kể bạch cầu ái toan trong đàm (tỉ lệ bạch cầu ái toan ≥ 3%). Trong một thử nghiệm hoán chuyển nhóm can thiệp, tăng bạch cầu ái toan trong đàm tiên đoán được lợi ích ngắn hạn của điều trị ICS liều cao ở bệnh nhân COPD có viêm phế quản tăng bạch cầu ái toan.73 Một nghiên cứu khác cho thấy rằng số lượng bạch cầu ái toan và nồng độ protein cationic do bạch cầu ái toan tiết ra trong dịch rửa phế quản phế nang ở bệnh nhân có đáp ứng với prednisone cao hơn một cách có ý nghĩa thống kê so với bệnh nhân COPD không đáp ứng với prednisone.74
Một ví dụ khác của cá thể hóa điều trị là bệnh nhân ACOS đang hút thuốc lá có thể cần phải dùng ICS liều cao hơn bệnh nhân ACOS đã ngưng hút thuốc lá.41, 63 Một nghiên cứu mù đôi ngẫu nhiên có nhóm chứng cho thấy rằng bệnh nhân hen nhẹ có hút thuốc lá thì được kiểm soát kém với ICS liều thấp. Tình trạng kém kiểm soát này sẽ được khắc phục khi ICS được cho với liều cao hơn.75
Người lớn tuổi bị ACOS cần được đặc biệt chú ý và quản lý cẩn thận. Mặc dù hô hấp ký có thể được đo thành công ở 90% bệnh nhân lớn tuổi bị bệnh tắc nghẽn đường dẫn khí mạn tính, khi kỹ thuật viên được huấn luyện thích hợp và chất lượng phòng đo hô hấp ký được đảm bảo,76 việc thực hiện hô hấp ký trong nhóm bệnh nhân này vẫn bị hạn chế do hợp tác kém.43 Khi không có thông tin về chức năng hô hấp, việc chẩn đoán xác định và đánh giá độ nặng của bệnh thường bị trì hoãn ở người lớn tuổi. Do đó, thỉnh thoảng bác sĩ phải cho bệnh nhân dùng ICS và/ hoặc LABA khi chưa có kết quả hô hấp ký và theo dõi sát đáp ứng lâm sàng. Hơn nữa, vì bệnh nhân lớn tuổi thường tuân thủ kém với điều trị và thường có tác dụng phụ của thuốc do dùng nhiều loại thuốc cho nhiều bệnh đồng mắc, họ nên được nhắc nhở về việc dùng thuốc và đánh giá tác dụng bất lợi của thuốc thường xuyên hơn.77
CÁC NGHIÊN CỨU TƯƠNG LAI VỀ ACOS
Các hiểu biết về ACOS còn hạn chế vì bệnh nhân ACOS thường bị loại khỏi các nghiên cứu lâm sàng, chẳng hạn bệnh nhân có tiền căn hen trong các nghiên cứu về COPD hoặc bệnh nhân có biểu hiện COPD trong các nghiên cứu về hen. Chúng ta cần các nghiên cứu quan sát dài hạn hoặc các nghiên cứu tiến cứu để trả lời các câu hỏi nghiên cứu sau. Câu hỏi nghiên cứu thứ 1, gene nào là yếu tố nguy cơ gây ra ACOS? Bằng cách sử dụng phương pháp GWAS (genome-wide association studies), một nghiên cứu gần đây nhận thấy vài gene có thể có liên quan đến ACOS.30 Nghiên cứu này cung cấp các thông tin đầy đủ liên quan đến di truyền, lâm sàng và hình ảnh học của ACOS. Từ nghiên cứu ban đầu này, chúng ta nên tiến hành các nghiên cứu khác để hiểu và kiểm chứng mối quan hệ giữa kiểu gene và kiểu hình của ACOS. Câu hỏi nghiên cứu thứ 2, đâu là cơ chế sinh bệnh học phân tử của ACOS? Chúng ta cần hiểu rõ cơ chế bệnh sinh của ACOS, nhận dạng các dấu ấn sinh học cụ thể cho việc chẩn đoán và phát triển các liệu pháp điều trị đích cho ACOS. Câu hỏi nghiên cứu thứ 3, diễn tiến tự nhiên hoặc tiên lượng của ACOS ra sao? Một nghiên cứu theo dõi dọc 5 năm đã mô tả diễn tiến tự nhiên của ACOS với việc sụt giảm chức năng phổi.78 Tốc độ sụt giảm FEV1 sau giãn phế quản ở bệnh nhân hen có tắc nghẽn đường dẫn khí cố định (giống nhóm bệnh nhân ACOS) (-49,7 ± 10,6 mL), tương tự như bệnh nhân COPD (-51,4 ± 9,8 mL, P = 0.71), nhưng nhanh hơn bệnh nhân hen có tắc nghẽn đường dẫn khí hồi phục hoàn toàn (-18,1 ± 10,1 mL, P < 0.01).78 Tuy nhiên, chúng ta biết rằng sự phát triển phổi bất thường ở tuổi nhỏ có thể gây tắc nghẽn đường dẫn khí cố định sau này,79 một nghiên cứu tiến cứu theo dõi từ lúc nhỏ là cần thiết. Câu hỏi nghiên cứu thứ 4, điều trị tối ưu cho ACOS là gì? Các nghiên cứu ngẫu nhiên có nhóm chứng nên được thực hiện ở các bệnh nhân ACOS, đặc biệt là ở bệnh nhân lớn tuổi.77
KẾT LUẬN
ACOS có thể là một từ tạm thời để chỉ các bệnh nhân mà bác sĩ khó có thể phân biệt được giữa hen và COPD.61 Một cách tiếp cận thay thế cho các bệnh tắc nghẽn đường thở mạn tính là mô tả các đặc điểm đặc trưng thay vì phân loại bệnh;80 điều này cho phép bác sĩ hình dung được tất cả các khía cạnh của bệnh và bắt đầu nghĩ về từng kiểu hình cụ thể và cách điều trị tương ứng.81 Dù gì đi nữa, chẩn đoán ACOS hiện là một thách thức cho bác sĩ; chúng ta cần các nghiên cứu tương lai để trả lời nhiều câu hỏi liên quan đến bệnh lý quan trọng này.
Lời cảm ơn
Các tác giả cảm ơn PGS. TS. BS. Lê Thị Tuyết Lan, Trung tâm Chăm sóc Hô hấp, Bệnh viện Đại học Y Dược TP. HCM, vì đã gợi ý những ý tưởng quý báu cho bản thảo. Chúng tôi cũng muốn cảm ơn phó trưởng biên tập và nhà phản biện vì đã đưa ra các nhận xét hữu ích.
TS. BS. NGUYỄN VĂN THỌ1, TS. BS. HYE YUN PARK2, và TS. BS. YASUTAKA NAKANO3
1Trung tâm Chăm sóc Hô hấp, Bệnh viện Đại Học Y Dược TP. HCM, Việt Nam
2Phân khoa Hô Hấp và Chăm Sóc Tích Cực, Khoa Y, Bệnh viện Samsung, Đại Học Y Khoa Sungkyunkwan, Seoul, Hàn Quốc
3Phân khoa Hô Hấp, Khoa Y, Đại Học Y Khoa Shiga, Shiga, Nhật Bản
Thư từ xin liên hệ:
TS. BS. Yasutaka Nakano
Phân khoa Hô Hấp, Khoa Y, Đại Học Y Khoa Shiga
Seta Tsukinowa-cho, Otsu, Shiga 520-2192, Japan
Fax: +81-77-543-5839
E-mail: This email address is being protected from spambots. You need JavaScript enabled to view it.
Về các tác giả:
Bác sĩ Thọ làm việc cho Trung tâm Chăm sóc Hô hấp Bệnh viện Đại Học Y Dược TP. HCM, một trung tâm chuyên về hen và COPD tại TP. Hồ Chí Minh. Anh ta từng là giáo sư trợ lý tại Phân khoa Hô Hấp, Đại Học Y Khoa Shiga, Nhật Bản. Anh ta chuyên nghiên cứu về mối quan hệ giữa cấu trúc và chức năng trong hen và COPD.
Bác sĩ Park là giáo sư trợ lý tại Phân khoa Hô hấp và Chăm sóc tích cực của Bệnh viện Samsung. Cô ta chuyên nghiên cứu để tìm các dấu ấn sinh học đặc hiệu cho COPD và cách tiếp cận các bệnh đồng mắc trong COPD.
Giáo sư Nakano là giáo sư lâm sàng và là trưởng Phân khoa Hô hấp, Khoa Y, Đại Học Y Khoa Shiga. Lĩnh vực nghiên cứu chính của ông ta bao gồm mối quan hệ về cấu trúc và chức năng trong các bệnh phổi, đặc biệt là trong hen và COPD.
Xung đột lợi ích: GS Yasutaka Nakano nhận tiền thù lao để báo cáo trong các hội nghị cho Nippon Boehringer Ingelheim Co., Ltd. và GlaxoSmithKline K.K. Ông ấy được Olympus Corporation trả tiền do là thành viên ban cố vấn công ty. Các tác giả khác không có xung đột lợi ích khi viết bài báo này.
Lịch sử bài báo: Nhận bản thảo: 30/4/2015; mời sửa chữa: 23/5 và 10/8/2015; nhận bản sửa chữa: 13/8/2015; chấp nhận đăng: 13/8/2015.
TÀI LIỆU THAM KHẢO
1 Global Initiative for Asthma (GINA). Global strategy for asthma management and prevention (updated 2015). Available at: http://www.ginasthma.org/. Accessed: 13 April 2015.
2 Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of COPD (updated 2015). Available at: http://www.goldcopd.org/. Accessed: 13 April 2015.
3 Jeffery PK. Remodeling and inflammation of bronchi in asthma and chronic obstructive pulmonary disease. Proc. Am. Thorac. Soc. 2004; 1: 176-83.
4 GINA and GOLD. Diagnosis of diseases of chronic airflow limitation: asthma, COPD and asthma-COPD overlap syndrome (ACOS) (updated 2015). Available at: http://www.ginasthma.org/. Accessed: 13 April 2015.
5 Postma DS, Reddel HK, ten Hacken NH, van den Berge M. Asthma and chronic obstructive pulmonary disease: similarities and differences. Clin. Chest Med. 2014; 35: 143-56.
6 Kim TB, Oh YM, Chang YS, Cho YS, Jang AS, Cho SH, Choi BW, Lee SD, Moon HB. The reality of an intermediate type between asthma and COPD in practice. Respir. Care 2012; 57: 1248-53.
7 Miravitlles M, Andreu I, Romero Y, Sitjar S, Altes A, Anton E. Difficulties in differential diagnosis of COPD and asthma in primary care. Br. J. Gen. Pract. 2012; 62: e68-75.
8 Braman SS. The chronic obstructive pulmonary disease-asthma overlap syndrome. Allergy Asthma Proc. 2015; 36: 11-8.
9 Bujarski S, Parulekar AD, Sharafkhaneh A, Hanania NA. The Asthma COPD Overlap Syndrome (ACOS). Curr. Allergy Asthma Rep. 2015; 15: 509.
10 Kauppi P, Kupiainen H, Lindqvist A, Tammilehto L, Kilpelainen M, Kinnula VL, Haahtela T, Laitinen T. Overlap syndrome of asthma and COPD predicts low quality of life. J. Asthma 2011; 48: 279-85.
11 Miravitlles M, Soler-Cataluna JJ, Calle M, Molina J, Almagro P, Quintano JA, Riesco JA, Trigueros JA, Pinera P, Simon A, Rodriguez-Hermosa JL, Marco E, Lopez D, Coll R, Coll-Fernandez R, Lobo MA, Diez J, Soriano JB, Ancochea J. Spanish guideline for COPD (GesEPOC). Update 2014. Arch. Bronconeumol. 2014; 50 Suppl 1: 1-16.
12 Diaz-Guzman E, Khosravi M, Mannino DM. Asthma, chronic obstructive pulmonary disease, and mortality in the U.S. population. COPD 2011; 8: 400-7.
13 de Marco R, Pesce G, Marcon A, Accordini S, Antonicelli L, Bugiani M, Casali L, Ferrari M, Nicolini G, Panico MG, Pirina P, Zanolin ME, Cerveri I, Verlato G. The coexistence of asthma and chronic obstructive pulmonary disease (COPD): prevalence and risk factors in young, middle-aged and elderly people from the general population. PLoS One 2013; 8: e62985.
14 Hersh CP, Jacobson FL, Gill R, Silverman EK. Computed tomography phenotypes in severe, early-onset chronic obstructive pulmonary disease. COPD 2007; 4: 331-7.
15 Andersen H, Lampela P, Nevanlinna A, Saynajakangas O, Keistinen T. High hospital burden in overlap syndrome of asthma and COPD. Clin. Respir. J. 2013; 7: 342-6.
16 Chung JW, Kong KA, Lee JH, Lee SJ, Ryu YJ, Chang JH. Characteristics and self-rated health of overlap syndrome. Int. J. Chron. Obstruct. Pulmon. Dis. 2014; 9: 795-804.
17 Fu JJ, Gibson PG, Simpson JL, McDonald VM. Longitudinal changes in clinical outcomes in older patients with asthma, COPD and asthma-COPD overlap syndrome. Respiration 2014; 87: 63-74.
18 Golpe R, Sanjuan Lopez P, Cano Jimenez E, Castro Anon O, Perez de Llano LA. Distribution of clinical phenotypes in patients with chronic obstructive pulmonary disease caused by biomass and tobacco smoke. Arch. Bronconeumol. 2014; 50: 318-24.
19 Hardin M, Silverman EK, Barr RG, Hansel NN, Schroeder JD, Make BJ, Crapo JD, Hersh CP. The clinical features of the overlap between COPD and asthma. Respir. Res. 2011; 12: 127.
20 Kitaguchi Y, Komatsu Y, Fujimoto K, Hanaoka M, Kubo K. Sputum eosinophilia can predict responsiveness to inhaled corticosteroid treatment in patients with overlap syndrome of COPD and asthma. Int. J. Chron. Obstruct. Pulmon. Dis. 2012; 7: 283-9.
21 Marsh SE, Travers J, Weatherall M, Williams MV, Aldington S, Shirtcliffe PM, Hansell AL, Nowitz MR, McNaughton AA, Soriano JB, Beasley RW. Proportional classifications of COPD phenotypes. Thorax 2008; 63: 761-7.
22 Menezes AM, Montes de Oca M, Perez-Padilla R, Nadeau G, Wehrmeister FC, Lopez-Varela MV, Muino A, Jardim JR, Valdivia G, Talamo C. Increased risk of exacerbation and hospitalization in subjects with an overlap phenotype: COPD-asthma. Chest 2014; 145: 297-304.
23 Milanese M, Di Marco F, Corsico AG, Rolla G, Sposato B, Chieco-Bianchi F, Costantino MT, Crivellaro MA, Guarnieri G, Scichilone N. Asthma control in elderly asthmatics. An Italian observational study. Respir. Med. 2014; 108: 1091-9.
24 Miravitlles M, Huerta A, Fernandez-Villar JA, Alcazar B, Villa G, Forne C, Cuesta M, Crespo C, Garcia-Rio F. Generic utilities in chronic obstructive pulmonary disease patients stratified according to different staging systems. Health Qual. Life Outcomes 2014; 12: 120.
25 Toy EL, Gallagher KF, Stanley EL, Swensen AR, Duh MS. The economic impact of exacerbations of chronic obstructive pulmonary disease and exacerbation definition: a review. COPD 2010; 7: 214-28.
26 Blanchette CM, Gutierrez B, Ory C, Chang E, Akazawa M. Economic burden in direct costs of concomitant chronic obstructive pulmonary disease and asthma in a Medicare Advantage population. J. Manag. Care Pharm. 2008; 14: 176-85.
27 Rhee CK, Yoon HK, Yoo KH, Kim YS, Lee SW, Park YB, Lee JH, Kim Y, Kim K, Kim J, Oh YM, Lee SD. Medical utilization and cost in patients with overlap syndrome of chronic obstructive pulmonary disease and asthma. COPD 2014; 11: 163-70.
28 Shaya FT, Dongyi D, Akazawa MO, Blanchette CM, Wang J, Mapel DW, Dalal A, Scharf SM. Burden of concomitant asthma and COPD in a Medicaid population. Chest 2008; 134: 14-9.
29 McDonald VM, Simpson JL, Higgins I, Gibson PG. Multidimensional assessment of older people with asthma and COPD: clinical management and health status. Age Ageing 2011; 40: 42-9.
30 Hardin M, Cho M, McDonald ML, Beaty T, Ramsdell J, Bhatt S, van Beek EJ, Make BJ, Crapo JD, Silverman EK, Hersh CP. The clinical and genetic features of COPD-asthma overlap syndrome. Eur. Respir. J. 2014; 44: 341-50.
31 Miravitlles M, Soriano JB, Ancochea J, Munoz L, Duran-Tauleria E, Sanchez G, Sobradillo V, Garcia-Rio F. Characterisation of the overlap COPD-asthma phenotype. Focus on physical activity and health status. Respir. Med. 2013; 107: 1053-60.
32 Fattahi F, ten Hacken NH, Lofdahl CG, Hylkema MN, Timens W, Postma DS, Vonk JM. Atopy is a risk factor for respiratory symptoms in COPD patients: results from the EUROSCOP study. Respir. Res. 2013; 14: 10.
33 Christenson SA, Steiling K, van den Berge M, Hijazi K, Hiemstra PS, Postma DS, Lenburg ME, Spira A, Woodruff PG. Asthma-COPD overlap. Clinical relevance of genomic signatures of type 2 inflammation in chronic obstructive pulmonary disease. Am. J. Respir. Crit. Care Med. 2015; 191: 758-66.
34 Mauad T, Dolhnikoff M. Pathologic similarities and differences between asthma and chronic obstructive pulmonary disease. Curr. Opin. Pulm. Med. 2008; 14: 31-8.
35 Guerra S, Martinez FD. Epidemiology of the origins of airflow limitation in asthma. Proc. Am. Thorac. Soc. 2009; 6: 707-11.
36 Postma DS, Kerkhof M, Boezen HM, Koppelman GH. Asthma and chronic obstructive pulmonary disease: common genes, common environments? Am. J. Respir. Crit. Care Med. 2011; 183: 1588-94.
37 Shirtcliffe P, Marsh S, Travers J, Weatherall M, Beasley R. Childhood asthma and GOLD-defined chronic obstructive pulmonary disease. Intern. Med. J. 2012; 42: 83-8.
38 Aanerud M, Carsin AE, Sunyer J, Dratva J, Gislason T, Jarvis D, deMarco R, Raherison C, Wjst M, Dharmage SC, Svanes C. Interaction between asthma and smoking increases the risk of adult airway obstruction. Eur. Respir. J. 2015; 45: 635-43.
39 James AL, Palmer LJ, Kicic E, Maxwell PS, Lagan SE, Ryan GF, Musk AW. Decline in lung function in the Busselton Health Study: the effects of asthma and cigarette smoking. Am. J. Respir. Crit. Care Med. 2005; 171: 109-14.
40 Perret JL, Dharmage SC, Matheson MC, Johns DP, Gurrin LC, Burgess JA, Marrone J, Markos J, Morrison S, Feather I, Thomas PS, McDonald CF, Giles GG, Hopper JL, Wood-Baker R, Abramson MJ, Walters EH. The interplay between the effects of lifetime asthma, smoking, and atopy on fixed airflow obstruction in middle age. Am J. Respir. Crit. Care Med. 2013; 187: 42-8.
41 Tamimi A, Serdarevic D, Hanania NA. The effects of cigarette smoke on airway inflammation in asthma and COPD: therapeutic implications. Respir. Med. 2012; 106: 319-28.
42 Broekema M, ten Hacken NH, Volbeda F, Lodewijk ME, Hylkema MN, Postma DS, Timens W. Airway epithelial changes in smokers but not in ex-smokers with asthma. Am. J. Respir. Crit. Care Med. 2009; 180: 1170-8.
43 Gibson PG, McDonald VM, Marks GB. Asthma in older adults. Lancet 2010; 376: 803-13.
44 van Schayck CP, Levy ML, Chen JC, Isonaka S, Halbert RJ. Coordinated diagnostic approach for adult obstructive lung disease in primary care. Prim. Care Respir. J. 2004; 13: 218-21.
45 Barrecheguren M, Esquinas C, Miravitlles M. The asthma-chronic obstructive pulmonary disease overlap syndrome (ACOS): opportunities and challenges. Curr. Opin. Pulm. Med. 2015; 21: 74-9.
46 Tzortzaki EG, Proklou A, Siafakas NM. Asthma in the Elderly: Can We Distinguish It from COPD? J. Allergy (Cairo) 2011; 2011: 843543.
47 Zeki AA, Schivo M, Chan A, Albertson TE, Louie S. The Asthma-COPD Overlap Syndrome: A Common Clinical Problem in the Elderly. J. Allergy (Cairo) 2011; 2011: 861926.
48 Vonk JM, Jongepier H, Panhuysen CI, Schouten JP, Bleecker ER, Postma DS. Risk factors associated with the presence of irreversible airflow limitation and reduced transfer coefficient in patients with asthma after 26 years of follow up. Thorax 2003; 58: 322-7.
49 Abramson MJ, Perret JL, Dharmage SC, McDonald VM, McDonald CF. Distinguishing adult-onset asthma from COPD: a review and a new approach. Int. J. Chron. Obstruct. Pulmon. Dis. 2014; 9: 945-62.
50 Lee JH, Haselkorn T, Borish L, Rasouliyan L, Chipps BE, Wenzel SE. Risk factors associated with persistent airflow limitation in severe or difficult-to-treat asthma: insights from the TENOR study. Chest 2007; 132: 1882-9.
51 Kerstjens HA, Engel M, Dahl R, Paggiaro P, Beck E, Vandewalker M, Sigmund R, Seibold W, Moroni-Zentgraf P, Bateman ED. Tiotropium in asthma poorly controlled with standard combination therapy. N. Engl. J. Med. 2012; 367: 1198-207.
52 Keith PK, Koch C, Djandji M, Bouchard J, Psaradellis E, Sampalis JS, Schellenberg RR, McIvor RA. Montelukast as add-on therapy with inhaled corticosteroids alone or inhaled corticosteroids and long-acting beta-2-agonists in the management of patients diagnosed with asthma and concurrent allergic rhinitis (the RADAR trial). Can. Respir. J. 2009; 16 Suppl A: 17A-31A.
53 Korn D, Van den Brande P, Potvin E, Dramaix M, Herbots E, Peche R. Efficacy of add-on montelukast in patients with non-controlled asthma: a Belgian open-label study. Curr. Med. Res. Opin. 2009; 25: 489-97.
54 Mirabelli MC, Beavers SF, Chatterjee AB. Active Asthma and the Prevalence of Physician-Diagnosed COPD. Lung 2014; 192: 693-700.
55 Tashkin DP. Is it asthma, COPD, or something in between, and does it matter? Respir. Care 2012; 57: 1354-6.
56 Tinkelman DG, Price DB, Nordyke RJ, Halbert RJ. Misdiagnosis of COPD and asthma in primary care patients 40 years of age and over. J. Asthma 2006; 43: 75-80.
57 Burgess JA, Walters EH, Byrnes GB, Wharton C, Jenkins MA, Abramson MJ, Hopper JL, Dharmage SC. Who remembers whether they had asthma as children? J. Asthma 2006; 43: 727-30.
58 Tashkin DP, Celli B, Decramer M, Liu D, Burkhart D, Cassino C, Kesten S. Bronchodilator responsiveness in patients with COPD. Eur. Respir. J. 2008; 31: 742-50.
59 D'Silva L, Hassan N, Wang HY, Kjarsgaard M, Efthimiadis A, Hargreave FE, Nair P. Heterogeneity of bronchitis in airway diseases in tertiary care clinical practice. Can. Respir. J. 2011; 18: 144-8.
60 Hancox RJ, Cowan DC, Aldridge RE, Cowan JO, Palmay R, Williamson A, Town GI, Taylor DR. Asthma phenotypes: consistency of classification using induced sputum. Respirology 2012; 17: 461-6.
61 Vanfleteren LE, Kocks JW, Stone IS, Breyer-Kohansal R, Greulich T, Lacedonia D, Buhl R, Fabbri LM, Pavord ID, Barnes N, Wouters EF, Agusti A. Moving from the Oslerian paradigm to the post-genomic era: are asthma and COPD outdated terms? Thorax 2014; 69: 72-9.
62 Nakawah MO, Hawkins C, Barbandi F. Asthma, chronic obstructive pulmonary disease (COPD), and the overlap syndrome. J. Am. Board Fam. Med. 2013; 26: 470-7.
63 Louie S, Zeki AA, Schivo M, Chan AL, Yoneda KY, Avdalovic M, Morrissey BM, Albertson TE. The asthma-chronic obstructive pulmonary disease overlap syndrome: pharmacotherapeutic considerations. Expert Rev. Clin. Pharmacol. 2013; 6: 197-219.
64 Chaudhuri R, Livingston E, McMahon AD, Lafferty J, Fraser I, Spears M, McSharry CP, Thomson NC. Effects of smoking cessation on lung function and airway inflammation in smokers with asthma. Am. J. Respir. Crit. Care Med. 2006; 174: 127-33.
65 Diaz-Guzman E, Mannino DM. Airway obstructive diseases in older adults: from detection to treatment. J. Allergy Clin. Immunol. 2010; 126: 702-9.
66 Nici L, Donner C, Wouters E, Zuwallack R, Ambrosino N, Bourbeau J, Carone M, Celli B, Engelen M, Fahy B, Garvey C, Goldstein R, Gosselink R, Lareau S, MacIntyre N, Maltais F, Morgan M, O'Donnell D, Prefault C, Reardon J, Rochester C, Schols A, Singh S, Troosters T. American Thoracic Society/European Respiratory Society statement on pulmonary rehabilitation. Am. J. Respir. Crit. Care Med. 2006; 173: 1390-413.
67 Montuschi P, Malerba M, Santini G, Miravitlles M. Pharmacological treatment of chronic obstructive pulmonary disease: from evidence-based medicine to phenotyping. Drug Discov. Today 2014; 19: 1928-35.
68 Welte T, Miravitlles M, Hernandez P, Eriksson G, Peterson S, Polanowski T, Kessler R. Efficacy and tolerability of budesonide/formoterol added to tiotropium in patients with chronic obstructive pulmonary disease. Am. J. Respir. Crit. Care Med. 2009; 180: 741-50.
69 Gershon AS, Campitelli MA, Croxford R, Stanbrook MB, To T, Upshur R, Stephenson AL, Stukel TA. Combination long-acting beta-agonists and inhaled corticosteroids compared with long-acting beta-agonists alone in older adults with chronic obstructive pulmonary disease. JAMA 2014; 312: 1114-21.
70 Magnussen H, Bugnas B, van Noord J, Schmidt P, Gerken F, Kesten S. Improvements with tiotropium in COPD patients with concomitant asthma. Respir. Med. 2008; 102: 50-6.
71 Peters SP, Kunselman SJ, Icitovic N, Moore WC, Pascual R, Ameredes BT, Boushey HA, Calhoun WJ, Castro M, Cherniack RM, Craig T, Denlinger L, Engle LL, DiMango EA, Fahy JV, Israel E, Jarjour N, Kazani SD, Kraft M, Lazarus SC, Lemanske RF, Jr., Lugogo N, Martin RJ, Meyers DA, Ramsdell J, Sorkness CA, Sutherland ER, Szefler SJ, Wasserman SI, Walter MJ, Wechsler ME, Chinchilli VM, Bleecker ER. Tiotropium bromide step-up therapy for adults with uncontrolled asthma. N. Engl. J. Med. 2010; 363: 1715-26.
72 Miravitlles M, Soler-Cataluna JJ, Calle M, Soriano JB. Treatment of COPD by clinical phenotypes: putting old evidence into clinical practice. Eur. Respir. J. 2013; 41: 1252-6.
73 Leigh R, Pizzichini MM, Morris MM, Maltais F, Hargreave FE, Pizzichini E. Stable COPD: predicting benefit from high-dose inhaled corticosteroid treatment. Eur. Respir. J. 2006; 27: 964-71.
74 Chanez P, Vignola AM, O'Shaugnessy T, Enander I, Li D, Jeffery PK, Bousquet J. Corticosteroid reversibility in COPD is related to features of asthma. Am. J. Respir. Crit. Care Med. 1997; 155: 1529-34.
75 Tomlinson JE, McMahon AD, Chaudhuri R, Thompson JM, Wood SF, Thomson NC. Efficacy of low and high dose inhaled corticosteroid in smokers versus non-smokers with mild asthma. Thorax 2005; 60: 282-7.
76 Bellia V, Pistelli R, Catalano F, Antonelli-Incalzi R, Grassi V, Melillo G, Olivieri D, Rengo F. Quality control of spirometry in the elderly. The SA.R.A. study. SAlute Respiration nell'Anziano = Respiratory Health in the Elderly. Am. J. Respir. Crit. Care Med. 2000; 161: 1094-100.
77 McDonald VM, Higgins I, Gibson PG. Managing older patients with coexistent asthma and chronic obstructive pulmonary disease: diagnostic and therapeutic challenges. Drugs Aging 2013; 30: 1-17.
78 Contoli M, Baraldo S, Marku B, Casolari P, Marwick JA, Turato G, Romagnoli M, Caramori G, Saetta M, Fabbri LM, Papi A. Fixed airflow obstruction due to asthma or chronic obstructive pulmonary disease: 5-year follow-up. J. Allergy Clin. Immunol. 2010; 125: 830-7.
79 Lange P, Celli B, Agusti A, Boje Jensen G, Divo M, Faner R, Guerra S, Marott JL, Martinez FD, Martinez-Camblor P, Meek P, Owen CA, Petersen H, Pinto-Plata V, Schnohr P, Sood A, Soriano JB, Tesfaigzi Y, Vestbo J. Lung-Function Trajectories Leading to Chronic Obstructive Pulmonary Disease. N. Engl. J. Med. 2015; 373: 111-22.
80 Weatherall M, Travers J, Shirtcliffe PM, Marsh SE, Williams MV, Nowitz MR, Aldington S, Beasley R. Distinct clinical phenotypes of airways disease defined by cluster analysis. Eur. Respir. J. 2009; 34: 812-8.
81 Pavord ID. Complex airway disease: an approach to assessment and management. Lancet Respir. Med. 2013; 1: 84-90.