- Chi tiết
-
Được đăng: 18 Tháng 10 2015
SUMMARY
Viêm phổi cộng đồng (VPCĐ) hiện nay vẫn còn là một trong những nguyên nhân hàng đầu trong mô hình bệnh tật và tử vong. Đã có rất nhiều tài liệu hướng dẫn (guideline) được chấp nhận và áp dụng. Tuy nhiên, cũng còn nhiều khoảng trống mà chúng ta chưa biết một cách rõ ràng. Bài viết này điểm lại những vấn đề có liên quan tới vi khuẩn gây bệnh thông thường, đặc tính kháng thuốc và các đề xuất trị liệu kháng sinh hiện nay. Trên cơ sở này tác giả cũng sẽ đề cập tới những vẫn đề còn chưa sáng tỏ, cần làm rõ trong VPCĐ.
Community-acquired pneumonia (CAP) so far still is one of the leading causes of disease patterns and deaths. There has been much guidelines that are accepted and applied. However, there remain many gaps that we do not know clearly. This article reviewed the issues related to common pathogens, their drug resistance characteristics and antibiotic treatment recommendations. On this basis the author will refer to the issues remained unclear, should be clarified in CAP.
ĐẶT VẤN ĐỀ
Viêm phổi cộng đồng (VPCĐ) đang là một trong những nguyên nhân nhập viện, tử vong và tiêu tốn chi phí y tế hàng đầu(1). Mặc dù tử vong trong bệnh lý này đã giảm nhiều từ sau khi có trị liệu kháng sinh vào thập niên 1950 nhưng từ sau đó tỷ lệ tử vong không giảm đáng kể, khoảng 8-15%(2,3) nói chung và khoảng 30% ở ICU(4)
Các guideline hiện nay khuyến cáo sử dụng kháng sinh dựa trên chiến lược phân loại bệnh nhân theo mức độ nặng và nơi điều trị. Bên cạnh đó, nhiều guideline cũng đề xuất thêm các yếu tố nguy cơ dự đoán khả năng nhiễm khuẩn kháng thuốc để hướng dẫn điều trị kinh nghiệm(5-7).
Nhiều nghiên cứu đã chứng minh điều trị theo hướng dẫn (guideline) giúp cải thiện các kết cục lâm sàng và giảm chí phí nguồn lực(8,9). Tuy nhiên, thất bại điều trị vẫn có thể xảy ra do vi khuẩn kháng thuốc hoặc do nhiễm các vi khuẩn gây bệnh không phổ biến(10). Việc xác định được nguy cơ kháng thuốc và biết tình hình kháng thuốc của vi khuẩn gây bệnh là tiền đề quan trọng để quyết định điều trị kháng sinh hợp lý.
VI KHUẨN GÂY BỆNH PHỔ BIẾN VÀ ĐẶC TÍNH KHÁNG THUỐC
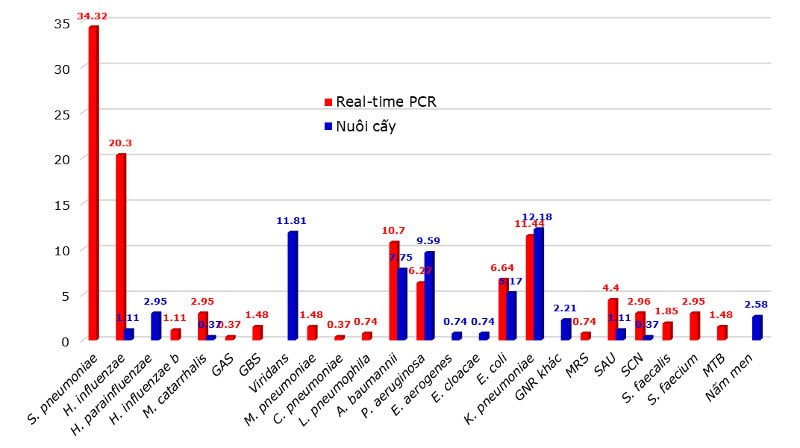
Đặc tính vi khuẩn gây bệnh phổ biến trong VPCĐ là giống nhau trên phạm vi toàn cầu(11-18). Ở hầu hết các khu vực trên thế giới, vi khuẩn gây bệnh phân lập được phổ biến nhất là S.pneumoniae. Tính phổ biến của vi khuẩn gây bệnh này đúng trên tất cả các mức độ nặng của VPCĐ, kể cả các trường hợp nặng cần nhập ICU(19,20). Đây chính là lý do mà khuyến cáo điều trị kháng sinh trong VPCĐ luôn cần bao vây S.pneumoniae. Hay gặp tiếp theo là nhóm các vi khuẩn không điển hình (L.pneumophila, Ch.pneumoniae và M.pneumoniae) và virus hô hấp. Các tác nhân vi sinh vừa kể trên có thể gây bệnh gây bệnh đơn độc lập hoặc cũng có thể kết hợp gây bệnh cùng với các vi khuẩn khác. Trong trường hợp kết hợp, bệnh cảnh viêm phổi thông thường là nặng. Các vi khuẩn gây bệnh khác bao gồm S.aureus và một số vi khuẩn Gram(-) (như H.influenzae, M.catarrhalis). Việc xem xét tác động của tình hình kháng thuốc trên các vi khuẩn gây bệnh phổ biến tới kết cục VPCĐ là rất cần thiết.
Trong khi chúng ta đã biết nhiều về tình hình kháng thuốc (prevalence), các yếu tố nguy cơ kháng thuốc và cơ chế kháng thuốc nhưng, điều quan trọng nhất, chúng ta lại chưa biết một cách rõ ràng là liệu chỉ riêng kháng thuốc có đủ tạo ra các tác động xấu (tử vong, thất bại điều trị, nhiễm khuẩn kéo dài) hay không(21-23). Chúng ta còn có ít các nghiên cứu được thiết kế tốt, mặc dù không phải chúng ta không lo lắng, để xác định được tác động lâm sàng trong điều trị bằng các kháng sinh thông thường trên các nhiễm khuẩn hô hấp phổ biến, thí dụ như với phế cầu(24-26). Trong khi ở một số tình trạng nhiễm khuẩn, thí dụ viêm màng não, viêm tai giữa, tình trạng kháng thuốc của vi khuẩn gây bệnh có tác động rõ ràng trên kết cục của bệnh thì trong VPCĐ, tác động này lại kém rõ ràng(24-27). Thậm trí có một số nghiên cứu đa trung tâm, ở nhiều khu vực trên thế giới nhận thấy kháng thuốc có tác động nhỏ tới tới kết cục bệnh(23,28). Tuy nhiên, rõ ràng là tình hình kháng thuốc đang theo chiều hướng gia tăng và thói quen chỉ định kháng sinh của thầy thuốc đang thay đổi theo chiều hướng ứng phó với tình trạng kháng thuốc(27,28).
Đã có nhiều nghiên cứu tình hình, diễn biến và nguy cơ kháng thuốc với quy mô thế giới(24,27-32). Trên cơ sở các nghiên cứu này, chúng ta đã biết tình hình kháng thuốc diễn biến không chỉ theo thời gian mà còn có sự khác biệt giữa các khu vực, các vùng địa lý. Hơn nữa, những nghiên cứu gần đây về dược động và dược lực học (PK-PD) thuốc kháng sinh đã làm sáng tỏ mối quan hệ giữa đặc tính dược lý thuốc và tính chất kháng thuốc của vi khuẩn với hiệu quả điều trị từ đó giúp chúng ta không chỉ hợp lý trong việc chọn thuốc mà còn trong việc chọn liều và cách sử dụng(33-35).
Streptococcus pneumoniae xuất hiện kháng thuốc với nhiều loại kháng sinh, bao gồm penicillin, cephalosporins (các betalactams), macrolides, fluoroquinolones, và thậm trí đã xuất hiện đa kháng thuốc(36-38). Do có ít bằng chứng về gia tăng tử vong do pneumococci kháng penicillin nên năm 2008 Viện chuẩn labo lâm sàng (Mỹ, CLSI) đã điều chỉnh lại ngưỡng kháng thuốc trên pneumococci không viêm màng não từ ≥ 2mcg/mL thành ≥ 8mcg/mL(37,38). Với ngưỡng kháng mới này, prevalence kháng penicillin giảm xuống rất thấp. Cơ chế pneumococci đề kháng với betalactam trước tiên là thay đổi proteins kết hợp thuốc (PBP-penicillin binding protein). Với mức kháng thuốc như hiện nay và việc điều chỉnh cách sử dụng thuốc phù hợp theo PK-PD thì dường như kháng penicillin không còn là vấn đề đáng quan ngại(26,27, 36,37,39). Nhiều nghiên cứu đã xác nhận hiệu quả điều trị của betalactam(39,40). Nhưng ngược lại, tình hình kháng với macrolide là cao và nghiêm trọng trên phạm vi toàn cầu(38). Hai cơ chế chính kháng macrolide, cụ thể là kháng ở mức thấp (MIC 1-32mcg/mL) do thay đổi cơ chế bơm đẩy do gen mef (A)quyết định và kháng ở mức cao (MIC>64mcg/mL) do cơ chế methyl hóa ribosome tác động lên vị trí kết hợp thuốc do gen erm (B) quyết định(27,38). Tỷ lệ kháng thuốc tùy theo hai cơ chế này là khác nhau giữa các khu vực trên thế giới. Mặc dù thất bại lâm sàng và vi trùng học của điều trị macrolide đã được chứng minh nhưng bằng chứng cũng còn ít và tương quan (correlation) giữa kháng thuốc và kết cục điều trị là khá thấp(41-45). Điều này thường được giải thích bằng thuật ngữ “không tương thích giữa in vitro và in vivo” và cũng đã có rất nhiều giả thuyết giải thích hiện tượng này(43,44). Tuy nhiên, do tình trạng kháng, nhóm thuốc này chỉ được khuyến cáo điều trị đơn độc trong trường hợp không có nguy cơ kháng thuốc và ở những vùng có tình hình kháng thấp(26). Macrolides, như là một phần của trị liệu phối hợp, trong những trường hợp bệnh nặng và để bao vây các vi khuẩn nhóm không điển hình đang được khuyến cáo(18, 36). Hiện nay, trên phạm vi toàn cầu, tình trạng pneumococcus kháng fluoroquinolone (FQ) còn rất hiếm nhưng đang có khuynh hướng gia tăng(38,46). Fluoroquinolone tác dụng trên vi khuẩn thông qua cơ chế ức chế tổng hợp DNA. Kháng thuốc xuất hiện bằng cơ chế đột biến các gen gyrA và parC. Ở các trường hợp ngưỡng kháng thấp, đột biến chủ yếu xảy ra ở vị trí parC và các trường hợp này còn nhậy cảm với các fluoroquinolone mới. Trong khi kháng ở mức độ cao có sự tham gia đồng thời đột biến ở cả 2 vị trí gen parC và gyrA(27). Kháng thông qua cơ chế bơm đẩy cũng có thể xảy ra nhưng ý nghĩa thực của cơ chế còn chưa biết rõ(27,47). Hiện nay, hiện tượng kháng với FQ còn được biết rất ít vì không thể chỉ dựa trên kết quả của xét nghiệm (in vitro) được. Có thể nhậy trên in vitro nhưng lại xuất hiện kháng trong quá trình điều trị và tình hình đột biến đơn kháng thuốc chúng ta còn chưa biết rõ(48).
M. pneumoniae không có cấu trúc thành (wall) tế bào nên do đó không chịu tác dụng với các kháng sinh ức chế tổng hợp cấu trúc thành tế bào (betalactam, glycopeptide, fosfomycin). Tuy nhiên, các kháng sinh khác (tetracycline, FQ, macrolide) lại có tác dụng tốt. Đây cũng là một đặc tính để nhóm vi khuẩn này được gọi là không điển hình. Với lý do này, nhiều guideline khuyến cáo macrolide như là lựa chọn đầu tiên cho điều trị viêm phổi do M.pneumoniae, vi khuẩn gây bệnh chiếm khoảng 11-15% các trường hợp VPCĐ(49). Tuy nhiên, tình hình kháng của vi khuẩn này với macrolide đã được thông báo trên trẻ em, nhất là ở Nhật bản(50). Gần đây cũng đã có thông báo gặp trên VPCĐ người lớn. Phân tích gen một trường hợp kháng thuốc ở người lớn Nhật bản kháng cao với macrolide người ta nhận thấy có đột biến gen ở một vị trí trên 23S rRNA, gen này có ở trên 90% trẻ em Nhật bản(50). Cho đến nay chưa thấy thông báo kháng của vi khuẩn này với minocycline hoặc FQ. Các chủng vi khuẩn kháng thuốc như vậy sau đó cũng đã được thông báo xuất hiện ở Pháp, Mỹ, Đan mạch, Trung quốc(51,52). Trên 90% các phân lập ở Trung quốc kháng với erythromycin và azithromycin(53). Nguyên nhân kháng thuốc của vi khuẩn này với macrolide còn chưa rõ ràng, tuy nhiên có thể là do việc sử dụng thuốc với liều thấp trong các bệnh phổi mạn tính(52). Nhiễm khuẩn do vi khuẩn này kháng thuốc trong đa số các trường hợp đều có tiền sử đã sử dụng macrolide trước đó(51) và trị liệu minocycline và FQ sẽ đem lại kết cục lâm sàng thuận lợi mặc dù không có thuốc nào trong số này là lý tưởng đối với trẻ em.
Haemophilus influenzae và Moraxella catarrhalis: H.influenzae là vi khuẩn quần tập (colonizer) phổ biến trên đường hô hấp trên, thậm trí trên người khỏe mạnh và có thể trên đường hô hấp dưới ở những bệnh nhân có bệnh lý hô hấp nền (underlying respiratory disorders)(54). Trong khi vi khuẩn này có thể gây nhiễm trùng đường hô hấp trên (viêm tai giữa, viêm xoang) và có vai trò quan trọng trong đợt cấp COPD thì nó cũng là nguyên nhân của khoảng 15% các trường hợp VPCĐ(54). Từ những năm của thập niên 1970, tình hình kháng kháng sinh của vi khuẩn này đã gia tăng. M.catarrhalis gần đây mới được xem là tác nhân gây bệnh quan trọng ở người và hiện nay vi khuẩn này được biết là vi khuẩn có tầm quan trọng chỉ sau H.influenzae trong đợt cấp COPD, nhiễm khuẩn hô hấp trên và chiếm khoảng 10% các trường hợp VPCĐ, nhất là ở những bệnh nhân ở hai thái cực của tuổi(54).
Tình trạng kháng thuốc của hai vi khuẩn này là phổ biến bằng cơ chế tiết betalactamase. Ban đầu betalactamase được ghi nhận ở H.influenzae type TEM-1. Sau đó, betalactamase mới, mang tên ROB-1, cũng được phát hiện(55). Cũng đã có phân lập kháng thuốc cho thấy không phải type TEM-1 cũng như ROB-1, do vậy đã có khả năng có nhiều type betalactamse mới khác(55). Đối với M.catarrhalis, betalactamase thông thường nhất là type ROB-1,2 và 3(54). Tình hình kháng thuốc không giống nhau trên phạm vi toàn thế giới. Trong dự án PROTEKT (theo dõi tình hình kháng thuốc toàn cầu) cho thấy có sự khác biệt rất rõ tỷ lệ kháng bằng cơ chế tiết betalactamase giữa các quốc gia. H.influenzae betalactamase(+) 1.8% ở Italy và 65% ở Hàn quốc. Trong khi đó có đến 92% trên tổng số phân lập M.catarrhalis là betalactamase(+)(54). Các dạng cơ chế kháng thuốc khác của H.influenzae cũng đã được phát hiện(55). Các chủng H.influenzae cũng đã kháng ampicillin nhưng không thông qua cơ chế tiết betalactamase (hay còn gọi là BLNAR- beta-lactamase negative ampicillin resistance) mà có thể là do thoái biến PBP(55). Các chủng BLNAR này gặp nhiều ở Nhật bản và Pháp(55). Có một số chủng sở hữa cả 2 cơ chế kháng (được gọi là BLPACR). Điều đáng lo ngại từ dự án PROTEKT là H.influenzae đã kháng trung gian với macrolide, trong khi hầu hết M.catarrhalis còn nhậy với các kháng sinh khác(54). Tiếp theo, cơ chế kháng bơm đẩy cũng đã được phát hiện trên H.influenzae mặc dù vẫn còn chưa có đồng thuận về vai trò của cơ chế này và cơ chế này còn tạo ra kháng ở mức thấp(54). Kháng tetracycline trong hai tác gây bệnh này có lẽ cũng do cơ chế bơm đẩy và kháng với FQ còn rất hiếm(54). Như vậy, với nhiễm H.influenzae, cũng cần lưu ý về chỉ định một số betalactam, macrolide/azalide và tetracycline, ít nhất là ở các khu vực có thông báo kháng thuốc(55). Đối với M.catarrhalis, betalactamase tỏ ra là cơ chế chính kháng với betalactam và vi khuẩn này còn nhậy với hầu hết các kháng sinh khác trong VPCĐ ngoài ampicillin/amoxicillin, bao gồm cephalosporin, macrolides/azalide, tetracycline và FQ(56,57).
Staphylococcus aureus là tác nhân nhiễm khuẩn quan trọng trên người trong đó có phổi. S.aureus kháng methixillin (MRSA) kháng giống nhau đối với tất cả các penicillins hiện hành và các betalactam khác. Kinh điển, nhiễm khuẩn MRSA là nhiễm khuẩn bệnh viện, nhiễm khuẩn từ các cơ sở chăm sóc y tế. Từ sau thập niên 1990, đã xuất hiện các trường hợp nhiễm cộng đồng MRSA hoàn toàn không có yếu tố nguy nhiễm khuẩn bệnh viện và ngày nay đang có nhiều nhận biết mới về chủng kháng thuốc cộng đồng này (gọi là CA-MRSA: community-associated MRSA)(58-60). Các chủng vi khuẩn CA-MRSA có vẻ gặp nhiều hơn ở Mỹ so với châu Âu(18). CA-MRSA kháng với các kháng sinh không-betalactam ít hơn so với HA-MRSA. Ở Mỹ, các chủng gây bệnh thường mang gene Panton Valentine Leukocidin (PVL) tạo độc tố và cũng rất có khả năng tạo biofilm(58), làm giảm khả năng tác động của kháng sinh điều trị. Xét nghiệm gen và chẩn đoán bằng kỹ thuật sinh học phân tử có thể phân biệt CA-MRSA với HA-MRSA(60,61). HA-MRSA thông thường mang gen SCCmec (type I, II, III) trong khi CA-MRSA thông thường nhỏ hơn, mang gen type IV, V hoặc VII(60). Gen PVL gặp nhiều hơn trên CA-MRSA. PVL có rất nhiều hoạt tính như gây độc, tiền viêm và có thể có vai trò quan trọng trong sinh bệnh học nhiễm trùng do CA-MRSA(60). Nhiễm trùng MRSA hiện nay đang được xem là một dạng lâm sàng mới nổi với tỷ lệ mắc và tử vong cao(60). Nhiễm trùng do vi khuẩn này đang có khuynh hướng xảy ra nhiều hơn trên người trẻ, khỏe mạnh và gây bệnh chủ yếu ở da và mô mềm. Cũng có thể thấy viêm phổi hoại tử do vi khuẩn này(18, 59,61,62). Ở Mỹ, nhiễm khuẩn MRSA khá phổ biến, chiếm trên 50% nhiễm khuẩn do staphylococcus ở cộng đồng(59). Cũng đã có thông báo nhiễm cộng đồng vi khuẩn này ở ngoài Mỹ mặc dù ở nhiều nơi trên thế giới không thấy hoặc rất hiếm gặp(58,59,61). Mô tả kinh điển trong dịch cúm hoặc tiền triệu dạng cúm sau đó khó thở cấp tính, nhiễm trùng toàn thân, ho máu(60). Tuy nhiên một vài nghiên cứu cho thấy không nhất thiết phải có bệnh cảnh dạng cúm và có một số bệnh nhân có tình trạng suy giảm miễn dịch (HIV, tiểu đường, leukemia, điều trị glucocorticoid, bệnh immunoglobulin)(62). Không có bệnh cảnh đặc trưng hoàn toàn cho nhiễm khuẩn MRSA nhưng hình thâm nhiễm hoại tử trên phim xquang ngực và tràn dịch màng phổi xuất hiện nhanh là triệu chứng gợi ý(62). Nhiễm khuẩn do MRSA khó điều trị hơn so với MSSA, chỉ có một số kháng sinh còn có hiệu quả tốt trong tình huống này. Vancomycin hoặc linezolid được khuyến cáo cho điều trị ban đầu(60). Tuy nhiên, đã có chứng minh thất bại điều trị với các phân lập mà MIC còn tỏ ra nhậy cảm(60). Các nghiên cứu cho rằng tỷ lệ tử vong cao hay cải thiện kết cục có liên quan với khả năng kháng sinh ức chế được tạo nội độc tố (clindamycin, linezolid) hoặc bệnh do nhiễm vi khuẩn không tạo độc tố(60). Do vậy mà hầu hết các khuyến cáo trong trường hợp tạo PVL đề nghị sử dụng kháng sinh (td. linezolid) hoặc kết hợp kháng sinh có khả năng làm giảm tạo ra PVL.
Trực khuẩn Gram(-): Ở một số vùng trên thế giới, nhiễm trực khuẩn Gram(-) như Klebsiella pneumoniae, Escherichia coli và các chủng vi khuẩn khác thuộc nhóm Enterobacteriacea có vẻ tương đối phổ biến(14,63). Trong những năm qua, đã có sự gia tăng kháng thuốc trong số các vi khuẩn gây bệnh nhóm này, bao gồm cả sự hiện diện của ESBL. Có ghi nhận ở nhiễm khuẩn cộng đồng và nhất là trên những người có sử dụng dịch vụ chăm sóc y tế (health care), đặc biệt là ở một số vùng(64-67). Nhiễm trùng nhóm này thường kết hợp với tăng tử vong, nhất là khi bị viêm phổi. Có rất nhiều dạng kháng thuốc đã được phát hiện trong nhóm trực khuẩn Gram (-) này(68).
KHUYẾN CÁO CHUNG ĐIỀU TRỊ KHÁNG SINH HIỆN NAY
Điều trị kháng sinh kinh nghiệm trong VPCĐ cần được bắt đầu càng sớm càng tốt sau khi có chẩn đoán. Đối với điều trị ngoại trú, cần lưu ý tới đặc điểm mới xuất viện, mới sử dụng kháng sinh, các các bệnh đồng mắc, để quyết định điều trị kháng sinh. Bên cạnh đó, đặc điểm dịch tễ kháng thuốc của từng địa phương cần phải được tham khảo để xây dựng phác đồ điều trị thường quy. Với tình hình pneumococci kháng macrolide <25%, có thể chỉ định macrolide hoặc doxycycline (guideline ATS/IDSA 2007)(5). Guideline Mỹ và Canada(69) thống nhất khuyến cáo đối với bệnh nhân ngoại trú, nếu có các bệnh đồng mắc hoặc vừa mới điều trị kháng sinh sử dụng FQ đơn độc hoặc betalactam (td. amoxicillin–clavulanate) kết hợp macrolide. Ngược lại, guideline của Anh, Thụy điển(7,70) lại khuyến cáo amoxicillin hoặc penicillin như là trị liệu kinh nghiệm cho VPCĐ ngoại trú. Có một số yếu tố ủng hộ việc sử dụng betalactam trị liệu kinh nghiệm cho bệnh nhân ngoại trú vì thứ nhất hầu hết các thầy thuốc không biết tình hình kháng thuốc thực của pneumococci và mặc dù hiểu rằng dịch tễ vi khuẩn gây bệnh không phải S.pneumoniae đã tăng nhưng họ vẫn không sử dụng macrolide vì cho rằng S.pneumoniae đã kháng cao với macrolide. Thứ hai, ở một số vùng trên thế giới, tỷ lệ kháng của S.pneumoniae với macrolide là rất cao(72). Thứ ba, nếu bệnh nhân không đáp ứng ngay với betalactam, các kháng sinh macrolide hay doxycycline sẽ là thuốc thay thế để điều trị khả năng nhiễm khuẩn không điển hình (td. M.pneumoniae). Ở Mỹ, có khoảng 1/3 H.influenzae và hầu hết M.catarrhalis betalactamase(+) nên amoxicillin–clavulanate là lựa chọn thay cho amoxicillin hoặc penicillin, nhất là trên bệnh nhân có bệnh lý phổi nền.
Đối với bệnh nhân cần nhập viện, khi không xác định được vi trùng học, ATS/IDSA khuyến cáo điều trị kinh nghiệm kết hợp betalactam với macrolide hoặc FQ đơn độc(5). Phác đồ điều trị này đã có rất nhiều nghiên cứu đánh giá với kết quả khỏi khoảng 90% bệnh nhân VPCĐ mức độ nhẹ tới trung bình(73,74).
Đối với bệnh nhân nhập ICU, các khuyến cáo đề nghị kết hợp betalactam với macrolide hoặc FQ(5). Guideline của Mỹ và Canada còn phân nhóm thêm những trường hợp có nguy cơ nhiễm pseudomonas thì cần điều trị kết hợp bằng các kháng sinh có tác dụng trên vi khuẩn này(75).
Quan điểm kết hợp thuốc cho đến nay vẫn chưa phải được đồng thuận cao. Các khuyến cáo kết hợp thuốc chủ yếu dựa trên các nghiên cứu hồi cứu với chứng minh rằng các phác đồ điều trị như vậy kết hợp với hiệu quả tốt về lâm sàng và chi phí y tế. Trong một bài báo với tiêu đề “Đơn trị so với kết hợp trong VPCĐ” năm 2004(75), Fernando J. Martinez đã nhận định khá thẳng thắn rằng chúng ta còn thiếu chứng minh bằng các thiết kế nghiên cứu tốt để có được lý lẽ dựa trên các bằng chứng sinh học, cũng như chưa có bằng chứng về điều hòa miễn dịch của macrolide hay tác dụng thực của các kháng sinh trên vi khuẩn không điển hình. Với thái độ tích cực không chỉ trong điều trị kết hợp kháng sinh mà còn trong việc theo dõi đánh giá, xử trí các rối loạn đồng thời có thể làm cho diễn biến của các trường hợp điều trị kết hợp kháng sinh tiến triển tốt hơn và có khả năng đây là nguy cơ dẫn đến kết luận sai của các dạng thiết kế hồi cứu.
KẾT LUẬN
Vẫn còn nhiều vấn đề chưa được giải quyết trong VPCĐ do khoảng một nửa số bệnh nhân chúng ta không xác định được vi khuẩn gây bệnh. Các nghiên cứu về hiệu quả điều trị còn thiếu bằng chứng về vi trùng học và chúng ta không tách bạch được đâu là tác động của nhiễm khuẩn và đâu là tác động của các rối loạn kết hợp trên các kết cục nghiên cứu. Cũng còn thiếu cơ sở để khẳng định những quan điểm mà thực sự vẫn còn mang nhiều tính giả thuyết như vai trò của vi khuẩn không điển hình, giá trị của macrolide trong điều hòa miễn dịch, vai trò thực của các vi khuẩn khó điều trị (td. pseudomonas, MRSA). Để tăng khả năng hướng dẫn thực hành, các nghiên cứu trong tương lai có lẽ cần làm sáng tỏ nguy cơ nhiễm khuẩn kháng thuốc, vai trò của các marker chẩn đoán nhiễm khuẩn và nhất là đánh giá được tác động của các phác đồ điều trị trên vi khuẩn gây bệnh.
TS BS Nguyễn Văn Thành
PCT VATLD
e-mail: This email address is being protected from spambots. You need JavaScript enabled to view it.
Hình ảnh: Image courtesy of dream designs at FreeDigitalPhotos.net
TÀI LIỆU THAM KHẢO
|
1. |
File TM Jr, Marrie TJ. Burden of community-acquired pneumonia in North American adults. Postgrad Med 2010; 122:130–141. |
|
2. |
Fine MJ, Smith MA, Carson CA, et al. Prognosis and outcomes of patients with community-acquired pneumonia. A meta-analysis. JAMA1996; 275:134–141. |
|
3. |
Rosó n B, Carratalà J, Dorca J, et al. Etiology, reasons for hospitalization, risk classes, and outcomes of community-acquired pneumonia in patients hospitalized on the basis of conventional admission criteria. Clin Infect Dis 2001; 33:158–165. |
|
4. |
Rodriguez A, Lisboa T, Blot S, et al. Mortality in ICU patients with bacterial community-acquired pneumonia: when antibiotics are not enough. Intensive Care Med 2009; 35:430–438. |
|
5. |
Mandell LA, Wunderink RG, Anzueto A, et al., Infectious Diseases Society of America; American Thoracic Society. Infectious Diseases Society of America/American Thoracic Society consensus guidelines on the management of community-acquired pneumonia in adults. Clin Infect Dis 2007; 44 (Suppl 2):S27–S72. |
|
6. |
Woodhead M, Blasi F, Ewig S, et al., Joint Taskforce of the European Respiratory Society and European Society for Clinical Microbiology and Infectious Diseases. Guidelines for the management of adult lower respiratory tract infections. Clin Microbiol Infect 2011; 17 (Suppl 6):E1–E59. |
|
7. |
Lim WS, Baudouin SV, George RC, et al. Pneumonia Guidelines Committee of the BTS Standards of Care Committee. BTS guidelines for the management of community acquired pneumonia in adults: update 2009. Thorax 2009; 64 (Suppl 3):iii1–iii55. |
|
8. |
McCabe C, Kirchner C, Zhang H, et al. Guideline-concordant therapy and reduced mortality and length of stay in adults with community-acquired pneumonia: playing by the rules. Arch Intern Med 2009; 169:1525–1531. |
|
9. |
Attridge RT, Frei CR, Restrepo MI, et al. Guideline-concordant therapy and outcomes in healthcare-associated pneumonia. Eur Respir J 2011; 38:878–887. |
|
10. |
McCabe C, Kirchner C, Zhang H, Daley J, Fisman DN. Guidelineconcordant therapy and reduced mortality and length of stay in adults with community-acquired pneumonia: playing by the rules. Arch Intern Med. 2009;169(16):1525–1531. |
|
11. |
Welte T, Torres A, Nathwani D. Clinical and economic burden of communityacquired pneumonia among adults in Europe. Thorax 2010 doi:10.1136/thx.2009.129502. |
|
12. |
File TM Jr., Marrie TJ. Burden of community-acquired pneumonia in North American adults. Postgraduate Medicine 2010; 122(2): 130-41. |
|
13. |
Isturiz RE, Luna CM, Ramirez J. Clinical and economic burden of pneumonia among adults in Latin America. Int J Infect Dis 2010; 14: e852 – e856 |
|
14. |
Song J-H, Thamlikitkul V, Hsueh P-R. Clinical and economic burden of communityacquired pneumonia amongst adults in the Asia-Pacific region. Int J Antimicrob Agents 2011; 38: 108 – 17. |
|
15. |
Feikin DR, Feldman C, Schuchat A, Janoff EN. Global strategies to prevent bacterial pneumonia in adults with HIV disease. Lancet Infect Dis 2004; 4: 445 – 55. |
|
16. |
Welte T, Köhnlein T. Global and local epidemiology of community-acquired pneumonia: The experience of the CAPNETZ Network. Seminars Respir Crit Care Med 2009; 30: 127 – 35. |
|
17. |
Woodhead M. The European vision of community-acquired pneumonia. Seminars Respir Crit Care Med 2009; 30: 136 – 45. |
|
18. |
Niederman MS. Community-acquired pneumonia: The U.S. perspective. Seminars Respir Crit Care Med 2009; 30: 179 – 88. |
|
19. |
Jones RN, Jacobs MR, Sader HS. Evolving trends in Streptococcus pneumoniae resistance: implications for therapy of community-acquired pneumonia. Int J Antimicrob Agent 2010; 36: 197 – 204. |
|
20. |
Polverino E, Marti AT. Community-acquired pneumonia. Minerva Anestesiologica 2011; 77: 196 – 211. |
|
21. |
Metlay JP, Singer DE. Outcomes in lower respiratory tract infections and the impact of antimicrobial drug resistance. Clin Microbiol Infect 2002; 8 (suppl 2): 1 – 11 |
|
22. |
Jacobs MR, Anon J, Appelbaum PC. Mechanisms of resistance among respiratory tract pathogens. Clin Lab Med 2004; 24: 419 – 53. |
|
23. |
Lynch JP III, Zhanel GG. Streptococcus pneumoniae: epidemiology and risk factors, evolution of antimicrobial resistance, and impact of vaccines. Curr Opin Pulm Med 2010; 16: 217 – 25. |
|
24. |
Metlay JP, Singer DE. Outcomes in lower respiratory tract infections and the impact of antimicrobial drug resistance. Clin Microbiol Infect 2002; 8 (suppl 2): 1 – 11. |
|
25. |
Jacobs MR, Anon J, Appelbaum PC. Mechanisms of resistance among respiratory tract pathogens. Clin Lab Med 2004; 24: 419 – 53. |
|
26. |
Feldman C. Clinical relevance of antimicrobial resistance in the management of pneumococcal community-acquired pneumonia. J Lab Clin Med 2004; 143: 269 –83. |
|
27. |
Lynch JP, III, Zhanel GG. Streptococcus pneumoniae: Does antimicrobial resistance matter? Seminars Respir Crit Care Med 2009; 30: 210 – 38. 19. Feldman C, Anderson R. Bacteraemic pneumococcal pneumonia. Drugs 2011; 71(2): 131 – 53. |
|
28. |
Felmingham D, Feldman C, Hryniewicz W, et al. Surveillance of resistance in bacteria causing community-acquired respiratory tract infections. Clin Microbiol Infect 2002; 8 (suppl 2): 12 – 42. |
|
29. |
Klugman KP, Low DE, Metlay J, Pechere J-C, Weiss K. Community-acquired pneumonia: new management strategies for evolving pathogens and antimicrobial susceptibilities. Int J Antimicrob Agents 2004; 24: 411 – 22. |
|
30. |
Alpuche C, Garau J, Lim V. Global and local variations in antimicrobial susceptibilities and resistance development in the major respiratory pathogens. Int J Antimicrob Agents 2007; 30S: S135 –S138. |
|
31. |
Goto H, Shimada K, Ikemoto H, Oguri T, the Study Group on antimicrobial susceptibility of Pathogens Isolated from Respiratory Infections. Antimicrobial susceptibility of pathogens isolated from more than 10 000 patients with infectious respiratory diseases: a 25-year longitudinal study. J Infect Chemother 2009; 15: 347 – 60. |
|
32. |
File TM, Jr. The science of selecting antimicrobials for community-acquired pneumonia (CAP). JMCP 2009; 15(2)(suppl): S5 – S11 |
|
33. |
Jacobs MR. Optimisation of antimicrobial therapy using pharmacokinetic and pharmacodynamic parameters. Clin Microbiol Infect 2001; 7: 589 – 96. |
|
34. |
Garau J. Role of beta-lactam agents in the treatment of community-acquired pneumonia. Eur J Clin Microbiol Infect Dis 2005; 24: 83 – 99. |
|
35. |
Owens RC, Jr., Shorr AF. Rational dosing of antimicrobial agents: Pharmacokinetic and pharmacodynamic strategies. Am J Health-Syst Pharm 2009; 66 (suppl 4): S23 – S30. |
|
36. |
Van Bambeke F, Reinert RR, Appelbaum PC, Tulkens PM, Peetermans WE. Multidrug-resistant Streptococcus pneumoniae infections. Current and future therapeutic options. Drugs 2007; 67(16): 2355 – 82. |
|
37. |
Jacobs MR. Antimicrobial-resistant Streptococcus pneumoniae: trends and management. Expert Rev Anti Infect Ther 2008; 6(5): 619 – 35. |
|
38. |
Song J-H, Chung DR. Respiratory infections due to drug-resistant bacteria. Infect Dis Clin N Am 2010; 24: 639 – 53. |
|
39. |
Garau J. Role of beta-lactam agents in the treatment of community-acquired pneumonia. Eur J Clin Microbiol Infect Dis 2005; 24: 83 – 99. |
|
40. |
Yu VL. Chiou CC, Feldman C, et al; International Pneumococcal Study Group. An international prospective study of pneumococcal bacteremia: correlation with in vitro resistance, antibiotics administered, and clinical outcome. Clin Infect Dis 2003; 37 (2): 230-7. |
|
41. |
Amsden GW. Pneumococcal macrolide resistance – myth or reality? J Antimicrob Chemother 1999; 44: 1- 6. |
|
42. |
Lonks JR, Garau J, Medeiros AA. Implications of antimicrobial resistance in the empirical treatment of community-acquired respiratory tract infections: the case of macrolides. J Antimicrob Chemother 2002; 50: (suppl S2): 87 – 91. |
|
43. |
Lynch JP III, Martinez FJ. Clinical relevance of macrolide-resistance Streptococcus pneumoniae for community-acquired pneumonia. Clin Infect Dis 2002; 34 (suppl 1): S27 – S46. |
|
44. |
Nuermberger E, Bishai WR. The clinical significance of macrolide-resistant Streptococcus pneumoniae: It’s all relative. Clin Infect Dis 2004; 38: 99 – 103. |
|
45. |
Fuller JD, McGeer A, Low DE. Drug-resistant pneumococcal pneumonia: clinical relevance and approach to management. Eur J Clin Microbiol Infect Dis 2005; 24: 780 – 88. |
|
46. |
Pletz MW, van der Linden M, von Baum H, Duesberg CB, Klugman KP, Welte T, for the CAPNETZ study group. Low prevalence of fluoroquinolone resistant strains and resistance precursor strains in Streptococcus pneumoniae from patients with community-acquired pneumonia despite high fluoroquinolone usage. International Journal of Medical Microbiology 2011; 301: 53 – 7. |
|
47. |
Lismond A, Carbonnelle S, Tulkens PM, van Bambeke F. Efflux of novel quinolones in contemporary Streptococcus pneumoniae isolates from community-acquired pneumonia. J Antimicrob Chemother 2011; 10: 948 – 51. |
|
48. |
Fuller JD, Low DE. A review of Streptococcus pneumoniae infection treatment failures associated with fluoroquinolone resistance. Clin Infect Dis 2005; 41: 118 – 21. |
|
49. |
Arnold FW, Summersgill JT, Lajoie AS, et al., and the Community-Acquired Pneumonia Organization (CAPO) investigators. A worldwide perspective of atypical pathogens in community-acquired pneumonia. Am J Respir Crit Care Med 2007; 175: 1086 – 93. |
|
50. |
Isozumi R, Yoshimine H, Morozumi M, Ubukata K, Ariyoshi K. Adult communityacquired pneumonia caused by macrolide resistant Mycoplasma pneumoniae. Respirology 2009; 14: 1206 – 16. |
|
51. |
Morozumi M, Takahashi T, Ubukata K. Macrolide-resistant Mycoplasma pneumoniae: characteristics of isolates and clinical aspects of community-acquired pneumonia. J Infect Chemother 2010; 16: 78 – 86. |
|
52. |
Miyashita N, Maruyama T, Kobayashi T, et al. Community-acquired macrolideresistant Mycoplasma pneumoniae pneumonia in patients more than 18 years of age. J Infect Chemother 2011; 17: 114 – 8. |
|
53. |
Bébéar C, Pereyre S, Peuchant O. Mycoplasma pneumoniae: Susceptibility and resistance to antibiotics. Future Microbiology 2011; 6(4): 423 – 31. |
|
54. |
Hoban D, Felmingham D. The PROTEKT surveillance study: antimicrobial susceptibility of Haemophilus influenzae and Moraxella catarrhalis from communityacquired respiratory tract infections. J Antimicrob Chemother 2002; 50 (suppl S1): 49 – 59. |
|
55. |
Tristram S, Jacobs MR, Appelbaum PC. Antimicrobial resistance in Haemophilus influenzae. Clin Microbiol Rev 2007; 20: 368 – 89. |
|
56. |
McGregor K, Chang BJ, Mee BJ, Riley TV. Moraxella catarrhalis: Clinical significance, antimicrobial susceptibility and BRO beta-lactamases. Eur J Clin Microbiol Infect Dis 1998; 17: 219 – 34. |
|
57. |
Murphy TF, Parameswaran GI. Moraxella catarrhalis, a human respiratory tract pathogen. Clin Infect Dis 2009; 49: 124 – 31 |
|
58. |
Stefani S, Bongiorno D, Cafiso V, et al. Pathotype and susceptibility profile of a community-acquired methicillin-resistant Staphylococcus aureus strain responsible for a case of severe pneumonia. Diagn Microbiol Infect Dis 2009; 63(1): 100 – 4. 36 |
|
59. |
Cataldo MA, Taglietti F, Petrosillo N. Methicillin-resistant Staphylococcus aureus: a community health threat. Postgrad Med 2010; 122(6): 16 – 23. |
|
60. |
Hidron AI, Low CE, Honig EG, Blumberg HM. Emergence of community-acquired methicillin-resistant Staphylococcus aureus strain USA300 as a cause of necrotizing community-onset pneumonia. Lancet Infect Dis 2009; 9: 384 – 92. |
|
61. |
David MZ, Daum RS. Community-associated methicillin-resistant Staphylococcus aureus: epidemiology and clinical consequences of an emerging epidemic. Clin Microbiol Rev 2010; 23 (3): 616 – 87. |
|
62. |
Lobo LJ, Reed KD, Wunderink RG. Expanded clinical presentation of communityacquired methicillin-resistant Staphylococcus aureus pneumonia. Chest 2010; 138(1): 130-6. |
|
63. |
Marques MR, Nunes A, Sousa C, et al. Community-acquired pneumonia in an intensive care unit. Rev Port Pneumol 2010; 16(2): 223 – 35. |
|
64. |
Sader HS, Sampaio JL, Zocoli C, Jones RN. Results of the 1997 SENTRY Antimicrobial surveillance program in three Brazilian medical centres. Braz J Infect Dis 1999; 3(2): 63 – 79. |
|
65. |
Einhorn AE, Neuhauser MM, Bearden DT, et al. Extended-spectrum betalactamases: frequency, risk factors, and outcomes. Pharmacotherapy 2002; 22(1): 14 – 20. |
|
66. |
Kang C-I, Song J-H, Chung DR, et al., on behalf of the Korean Network for Study of Infectious diseases (KONSID). Risk factors and treatment outcomes of community onset bacteraemia caused by extended-spectrum β-lactamase-producing Escherichia coli. Int J Antimicrob Agents 2010; 36: 284 – 87. |
|
67. |
Tsai SS, Huang JC, Chen ST, et al. Characteristics of Klebsiella pneumoniae bacteremia in community-acquired and nosocomial infections in diabetic patients. Chang Gung Med J 2010; 33(5): 532 – 9. |
|
68. |
Sader HS, Sampaio JL, Zocoli C, Jones RN. Results of the 1997 SENTRY Antimicrobial surveillance program in three Brazilian medical centres. Braz J Infect Dis 1999; 3(2): 63 – 79. |
|
69. |
Mandell LA, Marrie TJ, Grossman RF, Chow AW, Hyland RH. Canadian guidelines for the initial management of community-acquired pneumonia: an evidence-based update by the Canadian Infectious Diseases Society and the Canadian Thoracic Society. The Canadian Community-Acquired Pneumonia Working Group. Clin Infect Dis 2000; 31:383–421. |
|
70. |
Spindler C, Str.lin K, Eriksson L, et al. Swedish guidelines on the management of community-acquired pneumonia in immunocompetent adults — Swedish Society of Infectious Diseases 2012. Scand J Infect Dis 2012;44:885-902. |
|
71. |
Doern GV, Richter SS, Miller A, et al. Antimicrobial resistance among Streptococcus pneumoniae in the United States: have we begun to turn the corner on resistance to certain antimicrobial classes? Clin Infect Dis 2005;41:139-48. |
|
72. |
Kim SH, Song JH, Chung DR, et al. Changing trends in antimicrobial resistance and serotypes of Streptococcus pneumoniae isolates in Asian countries: an Asian Network for Surveillance of Resistant Pathogens (ANSORP) study. Antimicrob Agents Chemother 2012;56:1418-26. |
|
73. |
Johnstone J, Eurich DT, Majumdar SR, Jin Y, Marrie TJ. Long-term morbidity and mortality after hospitalization with community- acquired pneumonia: a population based cohort study. Medicine (Baltimore) 2008;87:329-34. |
|
74. |
Metersky ML, Waterer G, Nsa W, Bratzler DW. Predictors of in-hospital vs postdischarge mortality in pneumonia. Chest 2012;142:476-81 |
|
75. |
Fernando J. Martinez. Monotherapy versus Dual Therapy for Community-Acquired Pneumonia in Hospitalized Patients. Clinical Infectious Diseases 2004; 38(Suppl 4):S328–40 |