- Chi tiết
-
Được đăng: 29 Tháng 11 2017
Tóm tắt:
COPD là bệnh tiến triển nặng dần và là một trong những bệnh lý gây tử vong hang đầu sau đột quỵ và nhồi máu cơ tim.
Hiện nay chưa có thuốc nào được chứng minh có hiệu quả làm chậm sự giảm chức năng hô hấp, nhưng là bệnh có thể phòng ngừa và điều trị hiệu quả.
Thuốc giãn phế quản, đặc biệt loại tác dụng kéo dài, là nền tảng trong điều trị COPD. Mặc dù chưa có thuốc điều trị đặc hiệu, những thuốc nầy sử dụng một mình hay phối hợp LAMA, LAMA+LABA, ICS+LABA hay ICS+LABA+LAMA nhằm giảm triệu chứng, tăng chất lượng cuộc sống, giảm tần suất và độ nặng đợt cấp.
Mặc khác, kết hợp các nhóm thuốc giãn phế quản khác nhau có thể giúp cải thiện hiệu quả và giảm nguy cơ tác dụng phụ so với tăng liều một thuốc giãn phế quản đơn độc.
Abstract: Update of bronchodilators in treating chronic obstructive pulmonary disease
COPD is the usually progressive disease and the leading cause of mortality after stroke and myocardial infarction.
Bronchodilators, especially the long acting drugs, are the mainstone treatment of COPD. None of the existing medications has been shown to stop the long-term decline in lung function. Although until now, none specific medications , bronchodilators mono- or combination of LAMA, LAMA+LABA, ICS+LABA or ICS+LABA+LAMA can improve symptoms, improve the quality of life, reduce frequency and severity of exacerbation.
On other hand, Combining bronchodilators of different pharmacological classes may improve efficacy and decrease the risk of side effects compared to increasing the dose of asingle bronchodilator.
(*) PGS, TS. Chủ tịch Hội Hô hấp TPHCM, P.chủ tịch Hội Lao và Bệnh phổi VN, PCN Bộ môn Nội ĐHYD TPHCM.
I. ĐỊNH NGHĨA COPD THEO GOLD 2017:
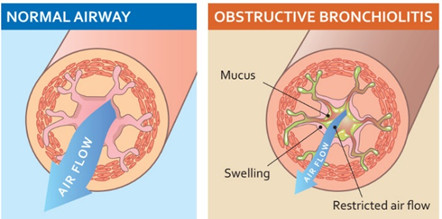
Bệnh phổi tắc nghẽn mạn tính (COPD), là 1 bệnh hay gặp của đường hô hấp, thường có thể dự phòng & điều trị được, đặc trưng bởi triệu chứng hô hấp dai dẳng và hạn chế dòng khí là do các bất thường tại phế nang và/hay đường dẫn khí, thường xuất phát từ sự tiếp xúc có ý nghĩa với các hạt hay khí độc[1]
II. ĐÁNH GIÁ COPD THEO GOLD:
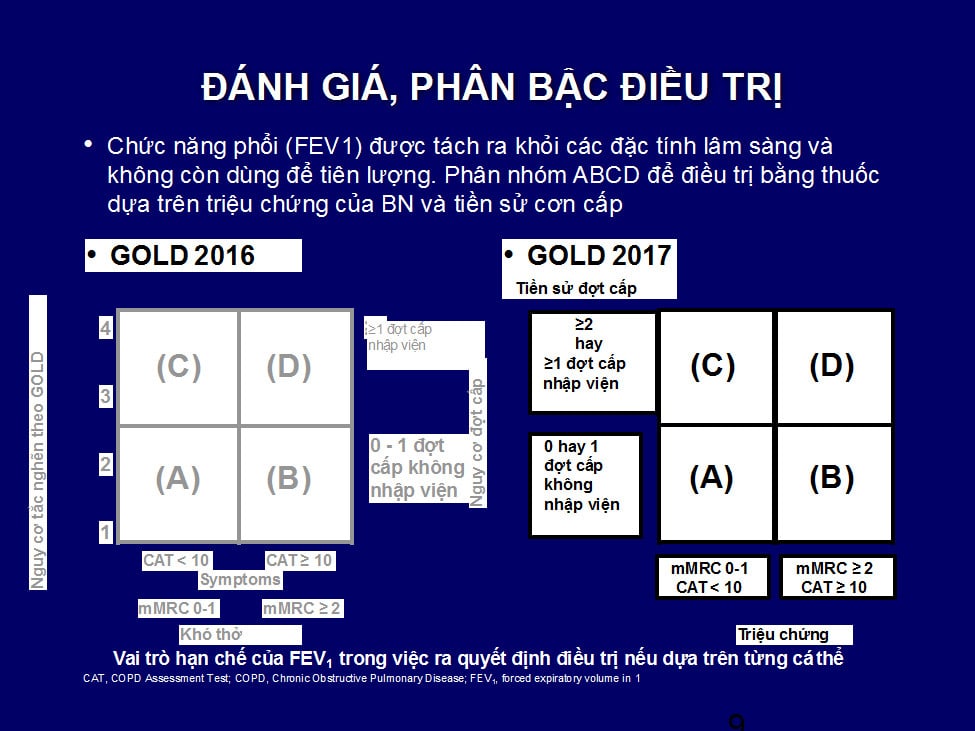
GOLD 2011 phân nhón BN COPD dựa trên sự kết hợp các đánh giá nhiều yếu tố như tắc nghẽn thông khí, tiền sử đợt cấp, điểm số triệu chứng khó thở và CAT (COPD assessment test)thành 4 nhóm COPD căn bản A, B, C, D và điều trị dựa trên phân loại như trên.
|
Nhóm bệnh nhân
|
Đặc trưng |
Số đợt cấp trong năm
|
mMRC
|
CAT |
|
A |
Nguy cơ thấp Ít triệu chứng
|
≤ 1 |
0-1 |
< 10 |
|
B |
Nguy cơ thấp Nhiềutriệu chứng
|
≤ 1 |
> 2 |
≥ 10 |
|
C |
Nguy cơ cao Ít triệu chứng
|
> 2 |
0-1 |
< 10 |
|
D |
Nguy cơ cao Nhiềutriệu chứng |
> 2 |
> 2 |
≥ 10 |
GOLD 2017, điều trị có sự thay đổi, dựa trên triệu chứng và tiền sử đợt cấp trong năm vừa qua để hướng dẫn điều trị. Tắc nghẽn thông khí chỉ được sử dụng trong chẩn đoán và phân giai đoạn tắc nghẽn, không làm căn cứ cho điều trị.
• Ví dụ: Có hai bệnh nhân COPD cùng có FEV1 < 30% và thang điểm CAT = 18 điểm
– BN A: không có cơn kịch phát/ năm qua
– BN B: 3 cơn kịch phát/ năm qua
Phân nhóm theo kiểu cũ: cả 2 thuộc nhóm D
Phân nhóm theo GOLD 2017:
– BN A: tắc nghẽn bậc 4 theo GOLD, nhóm B
– BN B: tắc nghẽn bậc 4 theo GOLD, nhóm D
III. ĐIỀU TRỊ THEO GOLD:
1. BIỆN PHÁP KHÔNG DÙNG THUỐC:
- Giáo dục BN và tự xử trí
- Cai thuốc lá
- Chích ngừa cảm cúm và viêm phổi
- Phục hồi chức năng
- Tập thể dục
- Dinh dưỡng
- Cận tử và chăm sóc giảm nhẹ
- Oxy liệu pháp
- Thở máy
- Nội soi phế quản can thiệp và phẫu thuật.
2. BIỆN PHÁP DÙNG THUỐC: có 2 mục đích
· Giảm các triệu chứng
o Giảm các triệu chứng
o Cải thiện tình trạng sức khỏe
· Giảm nguy cơ
o Ngăn chặn tiến triển của bệnh
o Ngăn chặn và điều trị đợt kịch phát
o Giảm tỷ lệ tử vong
• Hướng dẫn GOLD trước 2011: điều trị COPD dựa trên mức độ tắc nghẽn đường thở qua chỉ số FEV1.
• GOLD 2011-2017:
• Xác định và giảm tiếp xúc với các yếu tố nguy cơ là những bước quan trọng trong việc ngăn ngừa và điều trị COPD.
• Thuốc giãn phế quản được dùng khi cần thiết, hoặc thường xuyên để ngăn ngừa đợt cấp hoặc làm giảm triệu chứng, cải thiện chất lượng cuốc sống.
• Kết hợp các thuốc giãn phế quản nhóm khác nhau có thể cải thiện hiệu quả và làm giảm nguy cơ các tác dụng phụ so với tăng liều của một thuốc giãn phế quản.[1]
IV. CÁC THUỐC GIÃN PHẾ QUẢN TRONG ĐIỀU TRỊ COPD:
Thuốc kích thích β2 tác dụng kéo dài (LABA) đã được sử dụng những năm 1990,gồm formoterol và salmeterol, giúp cải thiện chức năng phổi, các triệu chứng khó thở và gắng sức, chất lượng cuộc sống, và có thể giảm tỷ lệ đợt cấp và ít tác dụng phụ [1]
Formoterol và salmeterol có thời gian tác dụng kéo dài 12 giờ sử dụng đơn độc hay phối hợp với ICS đã trở thành thường qui trong điều trị duy trì COPD giai đoạn ổn định. Tuy nhiên hiện nay, một số LABA tác dụng 24 giờ và hiệu quả hơn đã được nghiên cứu là lần lượt được cấp phép sử dụng. Indacaterol, một LABA có thời gian tác dụng 24 giờ.Kết quả sơ bộ từ các thử nghiệm lâm sàng lớn cho thấy indacaterol cải thiện chức năng phổi so với giả dược và thuốc giãn phế quản tác dụng kéo dài khác. LABA khác gồm carmoterol, vilanterol trifenatate và oldaterol cũng có tác dụng kéo dài 24 giờ tương tự và hiệu quả.[1]
LABA mỗi ngày một lần, dùng đơn độc hay phối hợp sẽ trở thành hiện thực trong tương lai rất gần nhằm tìm một hiệu quả tối ưu trong giãn phế quản và giảm đợt cấp COPD, rất thuận lợi cho COPD thông qua việc đơn giản hóa phác đồ điều trị cũng như cải tiến về hiệu quả.
LABA một mình hay kết hợp với đối kháng muscarinic tác dụng kéo dài có khả năng tiếp tục cải thiện kết quả cho bệnh nhân.
BN Nhóm A: [1]
- Tất cả BN nhóm A được cho thuốc giãn phế quản, dựa trên triệu chứng khó thở
- Chọn lựa tùy theo tính hữu hiệu trong việc giảm khó thở
- Có thể là giãn phế quản tác dụng ngắn hoặc dài
- Tiếp tục cho nếu thấy giảm triệu chứng
Trong nghiên cứu 12-tuần mù đôi 534 bệnh nhân COPD ổn định mức độ nặng vừa kết hợp β2 albuterol và ipratropium. Kết quả vào các ngày 1, 29, 57, và 85 cho thấy rằng điều trị kết hợp có sự thay đổi FEV1 lớn hơn đáng kể hơn so với sử dụng một mình (P <0,001).[2]
BN Nhóm B: [1]
· Điều trị ban đầu nên là thuốc giãn phế quản tác dụng dài
· Vì thuốc này tốt hơn thuốc giãn phế quản tác dụng ngắn khi cần
· Không phân biệt loại thuốc giãn phế quản tác dụng dài trong việc giảm nhẹ triệu chứng
· Sự chọn lựa tùy theo cảm nhận của bệnh nhân
· Dùng hai thuốc GPQ cho BN khó thở nặng
· Nếu thêm thuốc thứ hai không cải thiện triệu chứng à chuyển lại 1 thuốc
· BN nhóm B có thể có bệnh đồng mắc gây khó trong đánh giá triệu chứng
1. TIOTROPIUM:
Tiotropium, giãn phế quản hít mỗi ngày một lần duy nhất hiện đang có sẵn, là một LAMA cải thiện đáng kể chức năng của phổi, làm tăng khả năng gắng sức và phục hồi chức năng phổi, cải thiện tình trạng sức khỏe, và làm giảm các đợt kịch phát. [1,3]
Hai nghiên cứu ngẫu nhiên, đối chứng giả dược, mù đôi, giả đôi đã được tiến hành trên 1207 bệnh nhân COPD,6 tháng điều trị tiotropium với 18 mcg mỗi ngày một lần, salmeterol 50 mg hai lần mỗi ngày, hoặc giả dược kết hợp.Các đợt cấp được xác định kéo dài ít nhất 3 ngày và thường cần điều trị. Kết quả: Ít đợt kịch phát COPD / bệnh nhân -năm trong nhóm tiotropium (1,07 lần /năm) hơn so với nhóm dùng giả dược (1,49 / năm, P = 0.025), mặc dù nhóm salmeterol (1,23 / năm) không khác nhau giả dược.Tiotropium, nhưng không salmeterol, so với giả dược, tạo ra chậm trễ đáng kể trong thời gian xuất hiện đợt cấp đầu tiên trong thử nghiệm lâm sàng 6-tháng. Nhóm tiotropium có một 0,10 nhập viện trung bình mỗi năm vì đợt cấp COPD, so với 0,17 cho salmeterol và 0,15 với giả dược (không khác nhau về thống kê).[4]
Một thử nghiệm mù đôi, ngẫu nhiên, so sánh 4 năm điều trị với một trong hai tiotropium hoặc giả dược ở bệnh nhân COPD. BN được phép sử dụng tất cả các loại thuốc hô hấp, ngoại trừ các loại thuốc kháng cholinergic dạng hít. Cải thiện FEV1 trong nhóm tiotropium đã được duy trì trong suốt thử nghiệm (từ 87 đến 103 ml trước dãn phế quản và từ 47 đến 65 ml sau khi dãn phế quản, so với nhóm giả dược (P <0,001).[5]
Kết quả từ nghiên cứu UPLIFT ,tiotropium giảm số lượng trung bình đợt cấp 14% (P <0,001) 0,1.Số lượng trung bình đợt kịch phát dẫn đến nhập viện là hiếm và không có sự khác biệt đáng kể giữa hai nhóm nghiên cứu.Tổng cộng có 5.993 bệnh nhân được đưa vào nghiên cứu; 2.987 trong nhóm tiotropium và 3.006 ở nhóm giả dược.Bệnh nhân được theo dõi trong 4 năm và so với nhóm chứng, tiotropium kéo dài có ý nghĩa thời gian xuất hiện đợt cấp đầu tiên (16,7 so với 12,5 tháng) và thời gian nhập viện lần đầu vì đợt cấp (thấp hơn nguy cơ nhập viện; HR = 0,86, 95% CI = 0,78-0,95) 0,2
• Điều quan trọng là để làm nổi bật rằng nhóm chứng trong thử nghiệm UPLIFT bao gồm các bệnh nhân điều trị thông thường đối với COPD, bao gồm corticosteroid hít và / hoặc beta-2 tác dụng kéo dài lên đến 62% các trường hợp lúc ban đầu lên đến 73 % các trường hợp bất cứ lúc nào trong thời gian theo dõi. Các thử nghiệm lâm sàng đã chứng minh giảm đáng kể đợt kịch phát và nhập viện, ngay cả ở những bệnh nhân được điều trị với các thuốc khác có thể có khả năng ngăn chặn đợt cấp [6,7]
Nguy cơ tim mạch khi sử dụng thường xuyên bromide tiotropium hít ở bệnh nhân COPD ở mọi mức độ. Kết cục chủ yếu là một kết hợp các tác dụng phụ tim mạch, tử vong tim mạch, nhồi máu cơ tim không tử vong (MI) hay đột quỵ trong thời gian điều trị. Nguy cơ tương đối (RR) được ước tính bằng cách sử dụng mô hình tác động cố định và thống kê không đồng nhất
Kết quả nghiên cứu cho thấy không có sự gia tăng đáng kể nguy cơ các tác dụng phụ tim mạch với điều trị tiotropium.[8]
2. ACLIDINUM:
Trong hai nghiên cứu mù đôi, 52-tuần, Acclaim / COPD I (N = 843) và II (N = 804), bệnh nhân được chọn ngẫu nhiên để hít 200 mg aclidinium hoặc giả dược mỗi ngày một lần. Bệnh nhân được yêu cầu phải có FEV1/FVC ≤ 70% sau giãn phế quản và FEV1 <80%.Trong Acclaim / COPD I, tỷ lệ bệnh nhân bị đợt cấp trung bình – nặng là tương tự như trong aclidinium và nhóm giả dược (26,6% so với 25,7%, P = 0,9). Acclaim / COPD II, bệnh nhân trong nhóm aclidinium bị đợt cấp trung bình hoặc nặng ít hơn so với những người trong nhóm giả dược (33,2% so với 39,8%, tương ứng, P = 0,0046). Thời gian bị đợt cấp nặng đầu tiên đã được kéo dài đáng kể trong aclidinium Acclaim / COPD II (P = 0,01), nhưng không khác trong Acclaimi / COPD I (P = 0,9).[9]
3. GLYCOPYRRONIUM BROMIDE: (NVA237)
Nghiên cứu đánh giá ảnh hưởng của bromide glycopyrronium (NVA237) tác dụng kéo dài,đối kháng muscarinic, một ngày một lần, trên mức độ dung nạp gắng sức trong 95 bệnh nhân COPD trung bình- nặng. Bệnh nhân được phân ngẫu nhiên vào một thiết kế bắt chéo NVA237 50 ngày một lần hoặc giả dược trong 3 tuần.Kết quả nghiên cứu chỉ ra rằng NVA237 cao hơn đáng kể với giả dược trong việc tăng dung nạp gắng sức và isotime IC vào các ngày 1 và 21 điều trị (tất cả P <0,001).[10]
Bromide glycopyrronium, nghiên cứu lâm sàng trong COPD 1 (GLOW1) nhằm đánh giá hiệu quả, an toàn và dung nạp của NVA237 ở những bệnh nhân COPD trung bình đến nặng. 822 bệnh nhân COPD có tiền sử hút thuốc ≥ năm 10 gói, sau giãn phế quản FEV1 <80% và ≥ 30% dự đoán bình thường và FEV1/FVC <0,70. Bệnh nhân được chọn ngẫu nhiên để điều trị mù đôi với NVA237 50 mg một lần mỗi ngày hoặc giả dược trong 26 tuần. FEV1 được cải thiện đáng kể trong nhóm NVA237 so với giả dược trong suốt khoảng thời gian 24 giờ vào ngày 1 và tuần 12 và 26, và ở tất cả các lần khác và thời điểm. NVA237 làm giảm đáng kể nguy cơ đợt cấp đầu tiên COPD vừa / nặng 31% (P = 0,023).[11]
4. INDACATEROL:
Nghiên cứu về tính hiệu quả và an toàn của indacaterol so với giả dược và salmeterol
.Bệnh nhân COPD trung bình đến nặng đã được chọn ngẫu nhiên để điều trị mù đôi 6 tháng với indacaterol 150 mg mỗi ngày một lần, salmeterol 50 mg hai lần mỗi ngày hoặc giả dược. Hiệu quả chính là trough (24 giờ sau liều) FEV1 sau 12 tuần. 1002 bệnh nhân được chọn ngẫu nhiên và 838 (84%) hoàn thành nghiên cứu. Indacaterol tăng FEV1 tại Tuần lễ 12 170 mL so với placebo (P <0,001), và 60 mL hơn salmeterol (P <0,001).[12]
Bệnh nhân COPD trung bình - nặng đã được chọn ngẫu nhiên mỗi ngày một lần indacaterol 300 mg (n = 437) hoặc mg 600 (n = 428), formoterol hai lần mỗi ngày 12 mg (n = 435), hoặc giả dược (n = 432) cho 52 tuần trong một nghiên cứu song song mù đôi
Indacaterol tăng FEV1 sau 12 tuần 170 mL (cả hai liều) so với giả dược và 100 mL so với formoterol (P <0,001). Những sự khác biệt có ý nghĩa này được duy trì ở 52 tuần.[13]
5. INDACATEROL + GLYCOPYRRONIUM:
Nghiên cứu ngẫu nhiên mù đôi, đối chứng giả dược, bốn giai đoạn bắt chéo đánh giá hiệu quả và độ an toàn của ngày một lần QVA149, giãn phế quản kép bao gồm các indacaterol và glycopyrronium (NVA237), ở những bệnh nhân COPD trung bình-nặng.
154 bệnh nhân được phân ngẫu nhiên điều trị QVA149 (indacaterol/NVA237) 300/50 mg, indacaterol 300 mg, indacaterol 600 mg, hoặc giả dược, mỗi ngày một lần trong 7 ngày với thời gian wash out 7-ngày giữa mỗi lần trị liệu. Đánh giá FEV1 vào ngày thứ 7.
Sự khác biệt FEV1 vào ngày thứ 7 giữa QVA149 và giả dược là 226 mL (P <0,001). Sự khác biệt từ QVA149 và indacaterol 300 và 600 mg là 123 mL (P <0.001) và 117 mL (P <0,001), tương ứng.[14]
6. TIOTROPIUM + FORMOTEROL:
Tác dụng giãn phế quản tiotropium, formoterol, và kết hợp cả hai được so sánh trong 71 bệnh nhân COPD, được phân ngẫu nhiên, mù đôi, cách ba, bắt chéo. Nhóm điều trị được nhận hoặc tiotropium 18 mg mỗi ngày một lần, formoterol 12 mg, hoặc cả hai kết hợp mỗi ngày một lần trong ba giai đoạn 6-tuần. So với ban đầu, tiotropium cải thiện đáng kể FEV1 (0-12 h)trung bình ban ngày hơn formoterol (127 so với 86 mL), trong khi FEV1 trung bình ban đêm (12-24 h) không khác nhau (tiotropium 43 mL, formoterol 38 mL). Hiệu quả rõ rệt nhất bằng liệu pháp kết hợp (ban ngày 234 ml, thời gian đêm 86 mL), cả hai khác biệt đáng kể so với đơn chất.[15]
Nhóm C là nhóm ít triệu chứng nhưng có nguy cơ cao bị đợt cấp.[1]
· Nên bắt đầu bằng 1 loại giãn phế quản tác dụng dài
· 2 nghiên cứu đối đầu cho thấy LAMA tốt hơn LABA trong đề phòng đợt cấp à khuyên dùng LAMA
· BN có những cơn kịch phát dai dẳng à cho LABA/ LAMA hoặc ICS/ LABA. Do ICS tăng nguy cơ viêm phổi à khuyên dùng LABA/LAMA
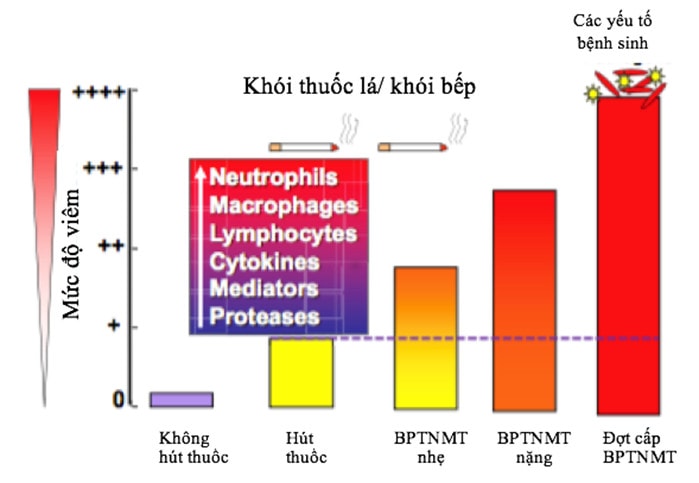
Bệnh nhân có đợt cấp thường xuyên có tỉ lệ tử vong cao hơn, chất lượng sống kém hơn, tăng viêm đường hô hấp, và suy giảm nhanh chóng trong chức năng phổi so với những người đợt cấp ít thường xuyên hơn.Đợt cấp COPD có liên quan đến viêm đường hô hấp và viêm toàn thân, hay đổi sinh lý, đặc biệt tăng ứ khí do nhiễm virus đường hô hấp và vi khuẩn. Một số bệnh nhân đặc biệt dễ bị đợt cấp và bệnh tiến triển nặng hơn những người có đợt cấp ít thường xuyên hơn [16].
Một nghiên cứu các đợt kịch phát cấp nặng của COPD ảnh hưởng trực tiếp trên tử vong.Một kỹ thuật đa biến được sử dụng để phân tích ảnh hưởng của các đợt cấp COPD điều trị trong bệnh viện về tuổi bệnh nhân, hút thuốc lá, chỉ số khối cơ thể, bệnh kèm theo, điều trị oxy dài hạn, các thông số hô hấp ký và khí máu động mạch trong một nghiên cứu đoàn hệ 304 người đàn ông với COPD theo dõi trong 5 năm.• Chỉ số tuổi tác, tăng CO2, và đợt cấp COPD là các chỉ số tiên lượng xấu. Bệnh nhân có nguy cơ tử vong lớn nhất là những người có ba hoặc nhiều hơn các đợt cấp COPD.[17]
2.138 bệnh nhân tham gia trong đánh giá (ECLIPSE) đợt cấp trong 3 năm.Các đợt cấp trở thành thường xuyên hơn (và nặng hơn) cũng như mức độ nghiêm trọng của COPD gia tăng, tỷ lệ trầm trọng trong năm đầu tiên theo dõi là 0,85 mỗi người cho các bệnh nhân COPD giai đoạn 2; 1,34 cho bệnh nhân với giai đoạn 3, và 2,00 cho bệnh nhân giai đoạn 4.Nhìn chung, 22% bệnh nhân bị bệnh giai đoạn 2, 33% với giai đoạn 3, và 47% với giai đoạn 4 vẫn còn có đợt cấp thường xuyên (hai hoặc nhiều trong năm đầu tiên theo dõi) mặc dù các phương tiện điều trị có sẵn [18].
Các nghiên cứu gần đây đã chỉ ra rằng những bệnh nhân bị ho mãn tính và có đờm có đợt cấp nhiều hơn hai lần so với bệnh nhân không có những triệu chứng. Trong số 2.500 bệnh nhân trong nghiên cứu COPD Gene những người có các triệu chứng của viêm phế quản mãn tính có đợt cấp đáng kể thường xuyên hơn và nghiêm trọng hơn so với bệnh nhân không có những triệu chứng này, mặc dù cả hai nhóm đều có FEV1 như nhau. Các triệu chứng của ho mãn tính và có đờm cũng liên quan với giảm chức năng phổi và tăng tỉ lệ tử vong.[19,20,21,22]
Sau 12 tuần điều trị, giảm có ý nghĩa thống kê số CD8 + (P <0,001) và CD68 + (P = 0.008) sau khi điều trị với SFC nhưng không phải với FP một mình, sự khác biệt trung bình CD8 + và CD68 + giữa SFC và giả dược có ý nghĩa thống kê (P <0,001 và P = 0,03, tương ứng). Sự khác biệt CD8 + và CD68 + giữa FP và giả dược không có ý nghĩa thống kê. Sự khác biệt có nghĩa là CD8 + và CD68 + giữa SFC và FP là có ý nghĩa thống kê (P = 0,01 và P = 0,04 cho các tế bào CD8 + và CD68 +, tương ứng). [23]
7. ICS/LABA VÀ ICS/ LAMA:
Tác dụng chống viêm của salmeterol / fluticasone (SFP), tiotropium / fluticasone (Tio + FP) và tiotropium (Tio) một mình đã được nghiên cứu trên các tế bào viêm và các chất trung gian trong đờm từ bệnh nhân COPD.Các đối tượng được hoặc mới được chẩn đoán hoặc đã không dùng bất kỳ loại thuốc trong vòng 3 tháng trước khi nghiên cứu. Đối tượng (n = 99) được chọn ngẫu nhiên, hoặc SFP (100/1, 000 mg hàng ngày), Tio + FP (18/1, 000 mg hàng ngày) hoặc Tio (18 mg hàng ngày) trong 12 tuần. Kết quả cho thấy rằng điều trị với SFP làm giảm đáng kể IL-8 và MMP-9 trong đờm, so với Tio một mình. Không có khác biệt điều trị giữa các SFP và Tio + FP trong giảm IL-8 và MMP-9. Tất cả các nhóm điều trị không làm giảm đáng kể tổng số tế bào, bạch cầu trung tính, đại thực bào và bạch cầu ái toan trong đờm. Ngoài ra, không có sự khác biệt CRP huyết tương.[24]
Một nghiên cứu đa trung tâm, ngẫu nhiên, mù đôi, song song được tiến hành ở bệnh nhân COPD để so sánh cải thiện chức năng phổi của tiotropium (18 mcg qd) cộng với formoterol (12 mg) so với salmeterol (50 mg) cộng với fluticasone (500 mcg).
Sau 6 tuần, CNHH 12-giờ nhóm tiotropium cộng với formoterol đã vượt trội so với nhóm salmeterol cộng với fluticasone (P = 0.0006). Sự khác biệt giữa hai phương pháp điều trị cũng có ý nghĩa tại mỗi điểm thời gian sau khi dùng thuốc (P <0,05).[25]
Nghiên cứu hiệu quả và khả năng dung nạp của budesonide / formoterol được thêm vào tiotropium ở những bệnh nhân hội đủ điều kiện để điều trị kết hợp ICS / LABA.Trong nghiên cứu 12 tuần ngẫu nhiên, mù đôi, song song, đa trung tâm, sau 2 tuần run-in, 660 nhận tiotropium (18 mcg mỗi ngày một lần) cộng với hoặc budesonide / formoterol (320/9 mcg) hoặc giả dược hai lần mỗi ngày.Budesonide / formoterol cộng với tiotropium làm tăng lên đáng kể FEV1 predose 6% và postdose 11%, so với tiotropium một mình (cả P <0,001).[26]
Nghiên cứu OPTIMAL được thực hiện để xác định xem việc kết hợp tiotropium với salmeterol hay fluticasone-salmeterol cải thiện kết cục lâm sàng ở người lớn với COPD trung bình đến nặng so với tiotropium một mình.Nghiên cứu ngẫu nhiên, mù đôi, dùng giả dược được tiến hành trên 449 bệnh nhân COPD trung bình hoặc nặng nhận được 1 năm điều trị với tiotropium cộng với giả dược, salmeterol tiotropium, hoặc tiotropium cộng với fluticasone salmeterol.Kết quả chỉ ra rằng tiotropium cộng với fluticasone salmeterol cao hơn đáng kể tiotropium một mình để tăng FEV1 (P = 0,049).[27]
8. Chất ức chế PDE4:
Ngược lại với hen phế quản, các tế bào viêm chính tham gia trong COPD là TB T CD8 +, bạch cầu trung tính và đại thực bào, tất cả đều là mục tiêu cho PDE4 inhibitors. Những tế bào này sản xuất các chất oxid hóa , chemokine (IL-8), các cytokine (TNF-a) và protease (elastase và metalloproteinase matrix)gây viêm mạn tính. Quá trình viêm dẫn đến phá hủy nhu mô phổi, mất tính đàn hồi và tắc nghẽn đường hô hấp nhỏ. Chuyển sản biểu mô và tăng tiết chất nhầy là tính năng nổi bật của COPD.[28,29]
Trong nghiên cứu chéo 4-tuần, các mẫu đờm của bệnh nhân dung roflumilast thấp hơn đáng kể về số lượng bạch cầu, bao gồm cả bạch cầu ái toan (P = 0,0005) và bạch cầu trung tính (P = 0,0017), so với các mẫu lấy từ bệnh nhân được điều trị với giả dược.
Ngoài ra, chất trung gian gây viêm giảm đáng kể, bao gồm IL-8 và elastase của Neutro trong đờm từ các bệnh nhân được điều trị roflumilast, so với bệnh nhân được điều trị bằng giả dược.[30]
Trong một nghiên cứu gộp 12-tháng hai nghiên cứu lâm sàng (M2-145 và M2-125), roflumilast làm giảm đáng kể tỷ lệ đợt cấp trung bình hoặc nặng 17% so với giả dược (P = 0,0003).Ngoài ra tỷ lệ thấp hơn đáng kể đợt cấp trầm trọng sau điều trị roflumilast, thời gian khởi phát đợt kịch phát lâu hơn đáng kể ở những bệnh nhân nhận được roflumilast hơn so với bệnh nhân dùng giả dược (HR = 0,89, P = 0,0185).[31]
Dữ liệu gộp từ 14 nghiên cứu kiểm soát giả dược, mù đôi giai đoạn II / III roflumilast 500 mg hoặc 250 mg mỗi ngày một lần so với giả dược trong COPD trung bình-rất nặng. Tám trong số 14 nghiên cứu đã được công bố trước đó (5766 bệnh nhân trong tổng số điều trị bằng roflumilast và 5491 với giả dược). Các tác dụng phụ thường gặp nhất xảy ra phổ biến hơn với roflumilast so với giả dược có tiêu chảy (12,2% so với 2,9%), giảm trọng lượng (7,0% so với 1,8%), buồn nôn (6,0% so với 1,5%), nhức đầu (5,1% so với 2,3%). Ngoài trọng lượng giảm, phần lớn của những tác dụng phụ hồi phục trong vòng 3 tuần.[32]
Nhóm D: bệnh nhân có nhiều triệu chứng và nguy cơ cao của các đợt.
· Khởi đầu với LABA/LAMA > đơn trị
o Nếu chọn khởi đầu với một thuốc, ưu tiên LAMA trong ngừa đợt cấp
o LABA/LAMA > ICS/LABA
o Nhóm D có nguy cơ cao hơn bị viêm phổi khi dùng ICS
· Một số BN: ICS/LABA có thể là chọn lựa ưu tiên: ACOS, Eo tăng,
· Nếu BN còn nhiều đợt cấp
o LAMA/LABA/ICS
o Chuyển sang ICS/LABA
· Nếu BN vẫn còn bị kịch phát trên nền LABA/LAMA/ICS có 3 chọn lựa khác:
o Thêm roflumilast: nếu BN có FEV1 < 50%, viêm phế quản mạn, có ít nhất 1 đợt kịch phát/ năm qua
o Thêm macrolide: azithromycin có chứng cứ tốt nhất; cân nhắc việc phát sinh chủng vi trùng kháng thuốc
o Ngưng ICS: do thiếu hiệu quả, tăng nguy cơ tác dụng phụ (viêm phổi) và không nguy hiểm nếu hít ICS
Trần văn Ngọc(*)
TÀI LIỆU THAM KHẢO:
1. From the Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease, Global Initiative for Chronic Obstructive Lung Disease (GOLD) 2011-2017. Available from: http://www.goldcopd.org.
2. COMBIVENT Inhalation Aerosol Study Group. In chronic obstructive pulmonary disease, a combination of ipratropium and albuterol is more effective than either agent alone. An 85-day multicenter trial. Chest. 1994;105:1411-1419.
3. Tashkin DP, Celli B, Senn S, Burkhart D, Kesten S, Menjoge S, Decramer M, for the UPLIFT study investigators: A 4-year trial of tiotropium in chronic obstructive pulmonary disease. N Engl J Med 2008;359:1543–54.
4. Brusasco V, Hodder R, Miravitlles M, Korducki L, Towse L, Kesten S. Health outcomes following treatment for six months with once daily tiotropium compared with twice daily salmeterol in patients with COPD. Thorax. 2003;58:399-404.
5. Casaburi R, Kukafka D, Cooper CB, Witek TJ Jr, Kesten S. Improvement in exercise tolerance with the combination of tiotropium and pulmonary rehabilitation in patients with COPD. Chest. 2005;127:809-817.
6. Tashkin DP, Celli B, Senn S, et al. A 4-year trial of tiotropium in chronic obstructive pulmonary disease. N Engl J Med. 2008;359:1543-1554.
7. Anzueto A, Miravitlles M. Efficacy of tiotropium in the prevention of exacerbations of COPD. Ther Adv Respir Dis. 2009;3:103-111.
8. Rodrigo GJ, Castro-Rodriguez JA, Nannini LJ, Plaza Moral V, Schiavi EA. Tiotropium and risk for fatal and nonfatal cardiovascular events in patients with chronic obstructive pulmonary disease: systematic review with meta-analysis. Respir Med. 2009;103:1421-1429.
9. Jones PW, Rennard SI, Agusti A, et al. Efficacy and safety of once-daily aclidinium in chronic obstructive pulmonary disease. Respir Res. 2011;12:55
10. Beeh KM, Singh D, Di Scala L, Drollmann A. Once-daily NVA237 improves exercise tolerance from the first dose in patients with COPD: the GLOW3 trial. Int J Chron Obstruct Pulmon Dis. 2012;7:503-513.
11. D'Urzo A, Ferguson GT, van Noord JA, et al. Efficacy and safety of once-daily NVA237 in patients with moderate-to-severe COPD: the GLOW1 trial. Respir Res. 2011;12:156.
12. Kornmann O, Dahl R, Centanni S, et al. Once-daily indacaterol vs twice-daily salmeterol for COPD: a placebo-controlled comparison. Eur Respir J. 2011;37:273-279.
13. Dahl R, Chung KF, Buhl R, et al. Efficacy of a new once-daily long-acting inhaled beta2-agonist indacaterol versus twice-daily formoterol in COPD. Thorax. 2010;65:473-479.
14. Van Noord JA, Buhl R, Laforce C, et al. QVA149 demonstrates superior bronchodilation compared with indacaterol or placebo in patients with chronic obstructive pulmonary disease. Thorax. 2010;65:1086-1091.
[15]Van Noord JA, Aumann JL, Janssens E, et al. Comparison of tiotropium once daily, formoterol twice daily and both combined once daily in patients with COPD. Eur Respir J. 2005;26:214-222.
16. Wedzicha JA, Seemungal TA. COPD exacerbations: defining their cause and prevention. Lancet. 2007;370:786-796.
17. Soler-Cataluña JJ, Martínez-García MA, Román Sánchez P, Salcedo E, Navarro M, Ochando R. Severe acute exacerbations and mortality in patients with chronic obstructive pulmonary disease. Thorax. 2005;60:925-931.
18. Hurst JR, Vestbo J, Anzueto A, et al. Susceptibility to exacerbation in chronic obstructive pulmonary disease. N Engl J Med. 2010;363:1128-1138.
19. Burgel PR et al. Cough and sputum production are associated with frequent exacerbations and hospitalizations in COPD subjects. Chest 2009;135:975–982.
20. Kim V et al. Chronic bronchitic symptoms are associated with worse symptoms and greater exacerbation frequency in COPD. Am J Respir Crit Care Med 2010;181:A1533.
21. Vestbo J, Prescott E and Lange P. Association of chronic mucus hypersecretion with FEV1 decline and chronic obstructive pulmonary disease morbidity. Am J Respir Crit Care Med 1996;153:1530–1535.
22. Guerra S, Sherrill DL, Venker C, et al. Chronic bronchitis before age 50 years predicts incident airflow limitation and mortality risk. Thorax 2009;64:894–900.
23. Bourbeau J, Christodoulopoulos P, Maltais F, et al. Effect of salmeterol/fluticasone propionate on airway inflammation in COPD: a randomised controlled trial. Thorax. 2007;62:938-943.
24. Perng DW, Tao CW, Su KC, Tsai CC, Liu LY, Lee YC. Anti-inflammatory effects of salmeterol/fluticasone, tiotropium/fluticasone or tiotropium in COPD. Eur Respir J. 2009;33:778-784.
25. Rabe KF, Timmer W, Sagkriotis A, Viel K. Comparison of a combination of tiotropium plus formoterol to salmeterol plus fluticasone in moderate COPD. Chest. 2008;134:255-262.
26. Welte T, Miravitlles M, Hernandez P, et al. Efficacy and tolerability of budesonide/formoterol added to tiotropium in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2009;180:741-750.
27. Aaron SD, Vandemheen KL, Fergusson D, et al. Tiotropium in combination with placebo, salmeterol, or fluticasone-salmeterol for treatment of chronic obstructive pulmonary disease: a randomized trial. Ann Intern Med. 2007;146:545-555.
28. Barnette MS, Underwood D. New PDE inhibitors as therapeutics for the treatment of chronic lung disease. Curr Opin Pulm Med 2000; 6: 164–169.
29. Barnes PJ. Mechanisms of COPD. Differences from asthma. Chest 2000; 117 (Suppl 2): 10S–14S.
30. Grootendorst DC, Gauw SA, Verhoosel RM, et al. Reduction in sputum neutrophils and eosinophil numbers by the PDE4 inhibitor roflumilast in patients with COPD. Thorax. 2007;62;1081-1087.
31. Calverley PMA, Rabe KF, Goehring UM, et al. Roflumilast in symptomatic chronic obstructive disease: two randomized clinical trials. Lancet. 2009;374:685-694.
32. Calverley PM, Martinez FJ, Fabbri L et al. Does roflumilast decrease exacerbations in severe COPD patients not controlled by inhaled combination therapy? the REACT study protocol. Int J Chron Obstruct Pulmon Dis. 2012;7:375-82.