- Chi tiết
-
Được đăng: 25 Tháng 5 2021
Tóm tắt:
Có vai trò quan trọng của nhiễm trùng mạn tính trên đường thở trong sinh bệnh học COPD nhưng mức độ, cách tác động không giống nhau giữa bệnh nhân này và bệnh nhân khác. Macrolide, nhóm kháng sinh có cấu trúc vòng lactone 14 thành phần có khả năng tác dụng điều hòa miễn dịch và có các đặc tính dược động học tốt trong nhiễm trùng mạn tính đường thở. Khuyến cáo sử dụng kháng sinh nhóm macrolide trong điều trị COPD là nhằm tăng cường khả năng kiểm soát viêm, giảm đợt cấp, nhất là trên những trường hợp xác định bệnh có endotype nhiễm trùng. Ngay cả khi khả năng xuất hiện kháng thuốc, tác dụng phụ khi điều trị kéo dài đã được xem xét, macrolide điều trị liều thấp, kéo dài vẫn cần được cân nhắc, chỉ định trong những trường hợp COPD không kiểm soát được bằng các trị liệu chuẩn, khi bệnh nhân có nhiều đợt cấp và có bằng chứng nhiễm trùng đường thở mạn tính. Bài viết nhằm tổng quan tài liệu về mối liên hệ bệnh lý giữa viêm, nhiễm trùng trong COPD, qua đó xác định vai trò của trị liệu macrolide kết hợp trong xử trí COPD.
Summary:
Inflammation, infection and role of macrolide in COPD
There is an important role of chronic airway infection in the pathogenesis of COPD, but the magnitude and the way of action are not the same from one patient to another. Macrolides, a group of antibiotics with a 14-component lactone ring structure have immunomodulatory effects and have good pharmacokinetic properties in chronic airway infections. The use of macrolide antibiotics in the treatment of COPD is recommended to enhance the ability to control inflammation and reduce exacerbations, especially in those with confirmed endotype infections. Even when the possibility of developing resistance and side effects during long-term treatment has been considered, long-term and low-dose macrolide should be considered, indicated in cases of COPD uncontrolled with standard therapy, when patient has multiple exacerbations and evidence of chronic airway infection. This paper aims to document the pathological link between inflammation and infection in COPD, thereby defining the role of combined macrolide therapy in the management of COPD.
ĐẶT VẤN ĐỀ.
Sự phát triển của các kỹ thuật phân tử trong chẩn đoán vi sinh đã tạo ra một cuộc cách mạng làm thay đổi hiểu biết của chúng ta về sự tồn tại của vi khuẩn trên đường thở và cách các tế bào của con người tương tác với một số lượng lớn các vi sinh vật có trên đường thở ngay cả trong trạng thái khỏe mạnh (1,2). Với các hiểu biết mới này, các bệnh lý phế quản-phổi có nền tảng được xem là viêm mạn tính đang dần được hiểu sang khái niệm viêm-nhiễm. Khi môi trường bên trong (đường thở) của chúng ta thay đổi (bệnh lý, nhiễm trùng cấp, sử dụng thuốc hay kháng sinh, ô nhiễm khí thở hay thuốc lá) sẽ dẫn đến sự xáo trộn hệ vi sinh vật này và làm thay đổi bản chất viêm trong một số bệnh lý mạn tính. Hay nói một cách khác, tình trạng nhiễm trùng mạn tính trên đường thở thực sự là một thành tố quan trọng trong sinh bệnh học các bệnh lý viêm mạn tính và nó liên tục thay đổi.
COPD là bệnh lý phổ biến với nền tảng bệnh học là viêm mạn tính. Với nhận thức như trên, hoàn toàn có thể suy luận rằng môi trường do cộng đồng các vi sinh vật trên đường thở có thể tham gia tạo cảm ứng hoặc điều chỉnh các quá trình viêm, góp phần vào sinh bệnh học và kiểu hình lâm sàng tương ứng (3). Tuy nhiên, hiểu biết một cách cụ thể về cộng đồng vi sinh này, bản chất tương tác giữa chúng với cơ thể vẫn còn là một thách thức và chúng ta cũng mới chỉ đi được những bước đầu tiên trên con đường nhận thức này.
Năm 2002, trong một bài viết về vai trò của nhiễm khuẩn trong đợt cấp COPD, tác giả M.Miravitlles có đưa ra giả thuyết về sự liên quan giữa tăng gánh vi khuẩn trên đường thở, gia tăng tình trạng viêm với đợt cấp COPD, hay còn gọi là giả thuyết “giảm và tăng” (the "fall and rise" or quantitative hypothesis of acute bacterial chronic obstructive pulmonary disease exacerbations) dựa trên phân tích cho thấy có hiện tượng tăng số lượng vi khuẩn có mặt trên đường thở trên một số bệnh nhân COPD khi vào đợt cấp và có hiện tượng gia tăng phản ứng viêm cục bộ của cơ thể chủ song hành với tăng tải lượng vi khuẩn (4). Từ những quan sát trên có thể suy đoán rằng để xuất hiện các triệu chứng của đợt cấp phải có đủ một lượng vi khuẩn tối thiểu trên đường thở, tức là phản ứng viêm vượt ngưỡng, đủ mức nghiêm trọng để gây ra các triệu chứng lâm sàng của đợt cấp. Ngưỡng này có thể thay đổi tùy theo từng bệnh nhân do có tác động của các yếu tố làm thay đổi (tăng tuổi, suy giảm chức năng phổi, các bệnh đồng mắc, tình trạng tăng phản ứng đường thở). Tuy nhiên giả thuyết trên vẫn còn những câu hỏi chưa có câu trả lời như vai trò của nhiễm virus, của nhiễm vi khuẩn mới, vai trò của vi khuẩn vẫn còn lại trên đường thở sau đợt cấp và tác động của điều trị kháng sinh sau đợt cấp như thế nào? Cũng năm 2002 Sethi và cs có một nghiên cứu quan trọng kết luận rằng đợt cấp là do các chủng (serotype) vi khuẩn mới nhiễm gây ra mà không phải do tăng tải lượng vi khuẩn đã có trên đường thở (5). Tuy nhiên đến 2007, Sethi và cs trong một nghiên cứu khác cho rằng có hay không mối liên quan giữa tăng tải lượng vi khuẩn trên đường thở với nhiễm các chủng vi khuẩn mới trong đợt cấp vẫn là câu hỏi còn bỏ ngỏ (6).
Vậy sử dụng kháng sinh dự phòng nhằm làm giảm tải lượng vi khuẩn trên đường thở có làm giảm viêm và giảm đợt cấp trên các bệnh lý có nền tảng viêm mạn tính hay không?. Câu hỏi này đã được hai nghiên cứu cũng của M.Miravitlles năm 2009 (7) và Sethi năm 2010 (8) đề cập tới. Nghiên cứu của M.Miravitlles so sánh điều trị moxifloxacin 5 ngày so với giả dược trên những bệnh nhân COPD giai đoạn ổn định xác định có vi khuẩn gây bệnh (potentially pathogenic microorganisms, PPMs) cho thấy tải lượng PPMs giảm hơn nhưng sau 8 tuần tải lượng vi khuẩn lại tăng trở lại không khác biệt có ý nghĩa giữa 2 nhóm và nhất là không ghi nhận được việc làm giảm PPMs sau điều trị có tác động làm giảm đợt cấp sau đó trong theo dõi 5 tháng tiếp theo. Sethi thực hiện nghiên cứu ngẫu nhiên có đối chứng điều trị cách quãng moxifloxacin trong 5 ngày liên tiếp sau đó ngưng và lại lặp lại điều trị như trên sau 8 tuần với tổng cộng 6 chu kỳ điều trị so với giả dược. Nghiên cứu nhận thấy trị liệu moxifloxacin ngắt quãng làm giảm đợt cấp có ý nghĩa, nhất là trên phân nhóm có khạc đàm nhầy/mủ. Tuy nhiên, không có sự khác biệt có ý nghĩa ở các kết cục khác như chức năng phổi, điểm SGRQ, tỷ lệ nhập viện và tử vong. Hai nghiên cứu trên xuất phát từ nhận thức rõ mối tương quan viêm và nhiễm trùng trong sinh bệnh học COPD nhưng chưa chứng minh được hiệu quả rõ ràng khi tác động bằng kháng sinh, cụ thể là moxifloxacin, trong điều trị dự phòng làm giảm tải lượng vi khuẩn trên đường thở.
Macrolide điều trị dự phòng đã được chứng minh là có khả năng làm giảm đợt cấp và cải thiện các kết cục lâm sàng trong nhiều bệnh lý viêm-nhiễm trùng mạn tính phế quản-phổi (9-17). Gần đây, kháng sinh nhóm macrolide được chú ý ngày càng nhiều trong điều trị dự phòng đợt cấp COPD. Điểm cần nhấn mạnh là tác động của kháng sinh nhóm macrolide làm giảm các diễn biến xấu của bệnh không dựa trên hoạt tính kháng sinh (18-21). Bài viết này nhằm tổng quan tài liệu về liên quan giữa viêm, nhiễm trùng và vai trò điều trị dự phòng của macrolide trong COPD.
VIÊM VÀ NHIỄM TRÙNG TRONG COPD
Vi sinh vật đường hô hấp tạo ra được các vị trí thích hợp để chúng tồn tại cộng sinh với vật chủ. Thuật ngữ microbiome được dùng để chỉ các quần thể vi sinh vật phức tạp, sống trên bề mặt cơ thể và cộng sinh với vật chủ. Vi khuẩn tạo thành một phần của microbiome, tồn tại bình thường và được phản ứng miễn dịch niêm mạc cục bộ với sự kích hoạt tối thiểu các tế bào viêm, đặc biệt là tế bào lympho T, dung nạp. Trong một thời gian dài, vai trò của nhiễm khuẩn không được xem là quan trọng trong sinh bệnh học COPD. Những tiến bộ gần đây hiểu biết về hệ vi sinh vật ở người đã được tạo điều kiện thuận lợi nhờ phát hiện RNA ribosome 16S được bảo tồn cao có trong vi khuẩn. Ribosome 16S có trên tế bào vi khuẩn nhưng không có trên tế bào người. Khi sử dụng giải trình tự 16S người ta thấy rõ rằng có một số lượng lớn các loại vi khuẩn khác nhau hiện diện trong cơ thể người bình thường. Sự xâm chiếm của quần thể vi khuẩn này là một quá trình năng động với sự luân chuyển thường xuyên của các chủng khác nhau. Một số vi khuẩn trong hệ vi sinh vật này có khả năng gây bệnh nếu chúng di chuyển được vào đường hô hấp dưới. Những mầm bệnh tiềm ẩn này có thể khu trú ở đường hô hấp trên trong thời gian dài như H.influenzae, M.catarrhalis và S.pneumoniae hoặc trong từng thời gian nhất định như M.pneumoniae.
Đường hô hấp dưới kết nối trực tiếp với đường hô hấp trên và việc hít chất tiết với lượng nhỏ từ đường hô hấp trên xảy ra thường xuyên. Với việc sử dụng giải trình tự gen 16S gần đây người ta đã công nhận rằng đường hô hấp dưới thực tế không vô trùng mà chứa nhiều loại vi khuẩn. Vi khuẩn có trong đường hô hấp dưới có thể nhanh chóng bị tiêu diệt bởi các cơ chế bảo vệ nhưng cũng có thể tồn tại dưới dạng mầm bệnh gây viêm liên tục hoặc hình thành hệ vi sinh vật đường hô hấp dưới. Bệnh nhân mắc bệnh đường hô hấp mạn tính như COPD có phổ vi khuẩn ở đường hô hấp dưới khác với những người phổi bình thường (22,23). Những nghiên cứu theo hướng xác định vi khuẩn bằng giải trình tự 16S thường tìm thấy mối tương quan chặt chẽ giữa hệ vi sinh vật đường hô hấp trên và đường hô hấp dưới. Một số nghiên cứu đã ghi nhận đặc điểm vi sinh tồn tại không giống nhau ở các vị trí khác nhau trên đường hô hấp dưới (niêm mạc phế quản, nhu mô phổi) (24) và có sự hiện diện của H.influenzae trong nhu mô phổi bệnh nhân COPD (25,26). Khả năng vi khuẩn xâm nhập vào đường hô hấp dưới và tồn tại ở khoảng gian bào hoặc nội bào trong thời gian dài cũng có ý nghĩa rất quan trọng (27). Trong trạng thái này, các vi khuẩn có vai trò tham gia gây bệnh trong cơ chế viêm đường thở và gây tổn thương phổi. Sự hiện diện của vi khuẩn gây bệnh thường xuyên và tham gia vào quá trình viêm trên đường thở có thể là các kích thích đáp ứng miễn dịch dẫn đến hình thành các nang lympho dưới niêm mạc đường thở mà trên người bình thường không có (28). Hình ảnh của các nang lympho như trên có thể cho chúng ta hình dung về hoạt động miễn dịch được duy trì liên tục trên đường thở theo cơ chế đáp ứng với kháng nguyên do vi khuẩn tạo ra (pathogen-associated molecular patterns, PAMP) hay do tổn thương của chính niêm mạc đường thở tạo ra (damage-associated molecular patterns, DAMP) (29-31). Đáp ứng viêm làm gia tăng mất tương quan proteinase / antiproteinase và làm tăng nguy cơ vào đợt cấp (32). Tăng tải lượng vi khuẩn trên đường thở, tăng tình trạng viêm cũng đã được chứng minh là làm giảm chức năng phổi (33-35). Tuy nhiên sự tương tác giữa tải lượng vi khuẩn trên đường thở, tình trạng viêm và nhiễm trùng mới, nhất là virus để hình thành đợt cấp như thế nào vẫn chưa có câu trả lời thực sự rõ ràng. Nhiễm virus có thể làm giảm khả năng bảo vệ của vật chủ, dẫn đến tăng cường sinh sản vi khuẩn và gia tăng tình trạng viêm. Malia và cs gần đây đã chứng minh rằng nhiễm rhinovirus thực nghiệm có liên quan rất cao đến tỷ lệ đợt cấp do vi khuẩn ở bệnh nhân COPD (36). Nhiễm virus hô hấp làm thay đổi hệ sinh thái vi khuẩn trên đường thở và làm mất thăng bằng đáp ứng viêm và miễn dịch của cơ thể, tạo điều kiện cho xâm nhập vi khuẩn thứ phát (37). Các nghiên cứu sử dụng kỹ thuật chẩn đoán vi sinh bằng PCR cho thấy có đến 50% các đợt cấp phân lập được virus (23). Như vậy, nhìn một cách tổng quát, microbiome tham gia vào thúc đẩy quá trình viêm và hình thành đợt cấp trong COPD. Sethi và cs cũng đã mô tả các tác động qua lại giữa cơ thể chủ, phơi nhiễm với môi trường bên ngoài và tác động từ bên trong của microbiome trong một sơ đồ có tính vòng xoắn sinh bệnh học (32) như mô tả ở hình 1. Những tiến bộ trong hình ảnh học cũng đã cho thấy tổn thương giãn phế quản là phổ biến trong COPD (33). Hơn nữa, sự hiện diện của giãn phế quản có liên quan với ghi nhận tỷ lệ vi khuẩn có trên đường thở cao hơn, nhất là H.influenzae và P.aeruginosa. Những trường hợp COPD kèm giãn phế quản có hình ảnh tiên lượng xấu hơn những trường hợp không kèm giãn phế quản (33). Phải chăng cơ sở của các nhận xét này bắt nguồn từ vấn đề gia tăng viêm-nhiễm trùng như vòng xoắn bệnh
học Sethi và cs đã mô tả (32).
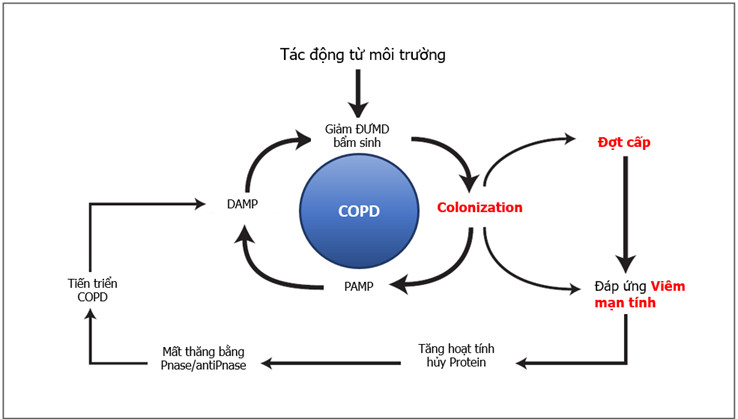
Hình 1. Vòng xoắn bệnh lý viêm và nhiễm trùng trong COPD (Sethi S, Murphy TF. Infection in the pathogenesis and course of chronic obstructive pulmonary disease. N Engl J Med 2008;359: 2355–2365) (32)
Nếu như trong COPD, ghi nhận H.influenzae là PPMs có mặt phổ biến nhất (21,35) thì trong bệnh xơ hóa nang (cystic fibrosis, CF) P.aeruginosa là phổ biến nhất (38). Mặc dù microbiome trên đường thở được xem là cộng đồng đa vi khuẩn, phức tạp nhưng sự hay gặp phổ biến của các loại vi khuẩn nào đó đối với từng nhóm bệnh cho chúng ta giả thuyết về khả năng tác động của phản ứng cơ thể, nhất là các tế bào viêm, đối với sự tồn tại của PPMs trên nền tổn thương đặc thù của từng loại bệnh, từng bệnh nhân và đặc tính sinh học riêng của vi khuẩn. Vi khuẩn xâm nhập vào đường hô hấp dưới phải trải qua một quá trình chuyển đổi từ vi sinh vật tự do (planktonic) sang dạng tồn tại dưới hình thức một quần thể phức tạp, bám dính được trên bề mặt niêm mạc trong một cấu trúc mà chúng ta gọi là màng sinh học vi khuẩn (bacterial biofilm). Trong cấu trúc biofilm này, vi khuẩn tồn tại được, có thể phát triển và trưởng thành, tránh né được các cơ chế bảo vệ và khi có điều kiện thuận lợi, chúng phá vỡ cấu trúc biofilm để trở thành các vi khuẩn tự do (21). Hình 2 thể hiện sự tồn tại và tương tác của H.influenzae với đáp ứng của cơ thể trong sinh bệnh học và đợt cấp COPD (21).
Bằng chứng cho rằng nhiễm khuẩn có liên quan tới sinh bệnh học COPD có thể tóm tắt, gồm: i) Có sự hiện diện của PPMs trong đàm trên gần 50% các trường hợp COPD giai đoạn ổn định, ii) Có hiện tượng vi khuẩn tồn tại trên đường hô hấp dưới (colonization) 33-73% các trường hợp COPD, iii) Tình trạng nhiễm trùng mạn tính có kết hợp với giảm chức năng hô hấp, tăng đợt cấp và đợt cấp nặng, iv) Sự hiện diện của vi khuẩn kết hợp với tăng marker viêm trong đợt cấp, v) Vi khuẩn hoạt hóa lympho T trong COPD và làm tăng đáp ứng tiền viêm (3). Như vậy, hướng tới giảm viêm, giảm đợt cấp trong COPD không thể không tính đến việc cần làm giảm tải lượng vi khuẩn trong microbiome trên đường thở. 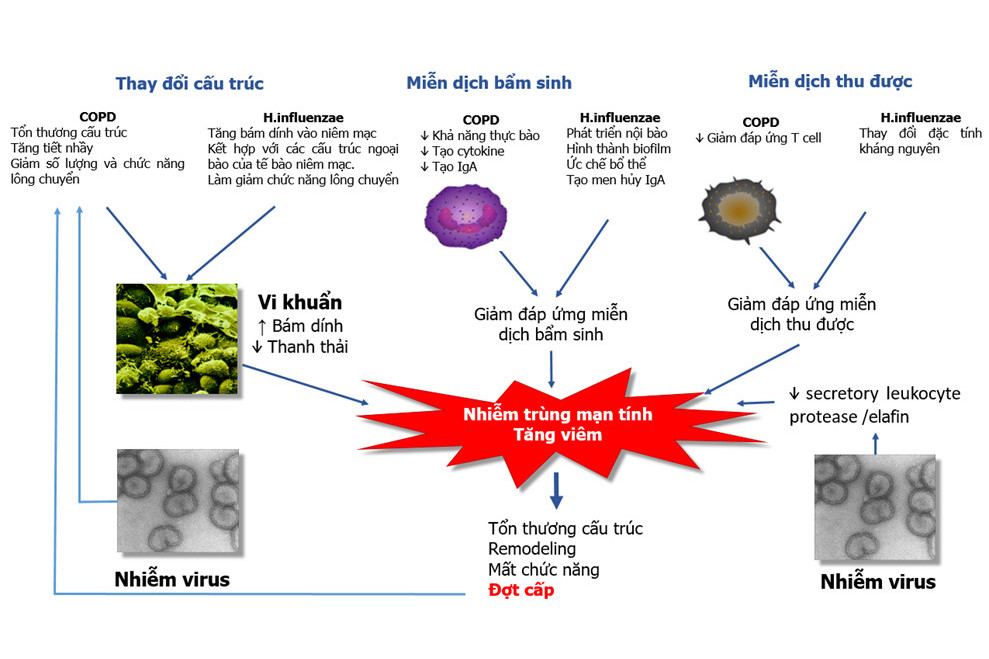
Hình 2 . Tác động qua lại giữa viêm và nhiễm trùng trong sinh bệnh học COPD và đợt cấp COPD (Lydia J Finney, Andrew Ritchie, Elizabeth Pollard et al. Lower airway colonization and inflammatory response in COPD: a focus on Haemophilus influenzae International Journal of COPD 2014:9 1119–1132) (21)
MACROLIDE KHÁNG SINH VÀ KHÁNG VIÊM
Thuốc kháng sinh nhóm macrolide là các hợp chất macrocyclic được chỉ định phổ biến trong điều trị nhiễm khuẩn hô hấp từ những năm 1990 trên cơ sở tác dụng kháng sinh bằng cách liên kết với rRNA 23S của vi khuẩn. Các nghiên cứu dịch tễ đang dấy lên sự lo ngại về hiệu quả kháng sinh của macrolide do tình hình kháng thuốc với tỷ lệ cao. Tuy nhiên tình hình kháng thuốc từ các kết quả nghiên cứu in vitro có thực sự tương quan với các kết quả in vivo trong thực hành điều trị hay không? (10,39). Nhiều nghiên cứu đã không ghi nhận có mối tương quan trên và macrolide vẫn được xem là thuốc kháng sinh có hiệu quả điều trị cao khi so sánh với các kháng sinh mới khác (40). Các nghiên cứu cho thấy macrolide hoạt động không chỉ bằng cơ chế kháng sinh mà còn bằng cơ chế kháng viêm với đặc tính tác dụng nội bào cao (41-45). Trong các cơ chế tác động trên vi khuẩn, cơ chế ức chế kinase điều hòa tín hiệu ngoài tế bào 1,2 (extracellular signal-regulated kinase, ERK 1,2) và các chất giải mã (transcription factors) của vi khuẩn là nổi bật, ổn định và không phụ thuộc vào hiệu lực kháng sinh (15). Đặc biệt, macrolide có khả năng xâm nhập và duy trì ở nồng độ cao, ổn định so với nồng độ huyết tương trong các cấu trúc biofilm, lớp dịch lót biểu mô, nơi trú ngụ của vi khuẩn hình thành trong các tổn thương viêm mạn
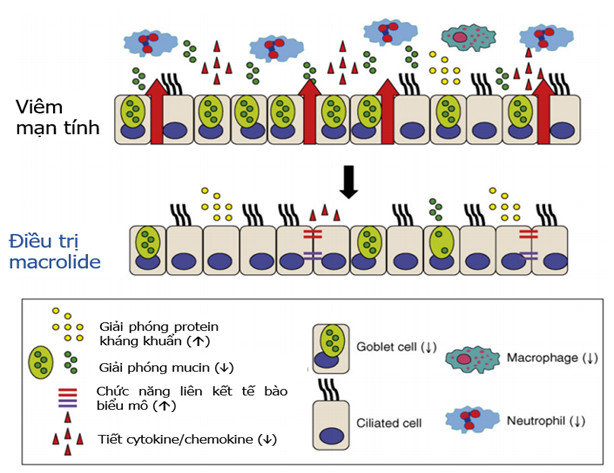
Hình 4. Khả năng tác dụng có lợi của điều trị macrolide đối với tính toàn vẹn và chức năng của hàng rào biểu mô. Trong các bệnh viêm mạn tính, tính thấm biểu mô tăng do tổn thương và suy yếu chức năng các phức hợp nối liên tế bào (biểu thị bằng các mũi tên màu đỏ), thâm nhập và tồn tại BCĐNTT trong đường thở do các tín hiệu được tạo ra bởi các tế bào biểu mô, do có sự gia tăng giải phóng chất chất trung gian viêm, protein mucin vào lòng đường thở. Tăng tiết chất nhầy góp phần vào việc kéo dài tình trạng viêm và / hoặc nhiễm trùng (bình thường không có) trong đường thở, dẫn đến tổn thương biểu mô mạn tính. Việc sửa chữa biểu mô bị mất điều hòa có thể dẫn đến việc hình thành cấu trúc tái tạo (remodeling). Macrolide có thể đóng góp để phục hồi chức năng hàng rào biểu mô bằng cách cải thiện các chức năng kháng khuẩn và phức hợp nối liên bào, làm giảm sản xuất cytokine và chemokine, và giảm sản xuất mucin từ các tế bào hình đài. Macrolide cũng có thể cải thiện khả năng thực bào của đại thực bào phế nang, giảm số lượng tế bào viêm trong lòng đường thở và góp phần giải quyết tình trạng viêm. Các mũi tên (â,á) cho biết hướng của những thay đổi khi điều trị macrolide trên các chất trung gian khác nhau (Yolanda S Lo´ pez-Boado, Bruce K Rubin. Macrolides as immunomodulatory medications for the therapy of chronic lung diseases Current Opinion in Pharmacology 2008, 8:286–291) (53)
tính (46-50). Với đặc tính trên, macrolide có thể có tác dụng trên vi khuẩn kể cả khi đã bị kháng in vitro (tác dụng kháng sinh liều thấp, dưới mức MIC) (51). Macrolide cũng có tác dụng điều hòa đáp ứng miễn dịch trên đường thở, các tế bào viêm, và tác động có lợi rõ ràng đối với nhiều loại bệnh phổi có nền tảng viêm mạn tính (52). Với các cơ chế tác động như trên, macrolide có khả năng làm giảm viêm đường hô hấp độc lập với tác động kháng khuẩn (40,49,53,54) (hình 4) (53). Hiệu quả và tính an toàn của macrolide điều trị kéo dài đã được chứng minh trong bệnh xơ hóa nang (cystic fibrosis, CF), viêm tiểu phế quản lan tỏa (diffuse panbronchiolitis, DPB), rối loạn vận động lông chuyển nguyên phát (primary ciliary dyskinesia, PCD) (8-15).
MACROLIDE SỬ DỤNG TRONG COPD
Trong COPD, đã có nhiều bằng chứng về sự tham gia của vi khuẩn trong sinh bệnh học giai đoạn ổn định, trong đợt cấp cũng như đã có nhiều bằng chứng về việc điều trị kết hợp macrolide trong COPD ổn định (15). Trong các phân tích gộp (55,56) các tác giả kết luận macrolide dự phòng là một cách tiếp cận hiệu quả để giảm các đợt cấp COPD. Trong một nghiên cứu ngẫu nhiên có đối chứng (RCT) điều trị azithromycin liều 250mg/ngày trong 12 tháng so sánh với giả dược cho bệnh nhân COPD nhiều đợt cấp khi đã loại trừ ra khỏi nghiên cứu các trường hợp giảm thính lực, khoảng QT trên ECG kéo dài, tim nhịp nhanh, các tác giả nhận định điều trị azithromycin làm giảm đợt cấp có ý nghĩa (HR 0.73, 95% CI, 0.63 to 0.84; P<0.001). Đi kèm là cải thiện thang điểm SGRQ. Có ghi nhận giảm thính lực so với nhóm giả dược (25% vs 20%, P=0.04), nhưng không ghi nhận các tác dụng ngoại ý nặng, cần ngưng điều trị (57). Nhiều tài liệu hướng dẫn quốc gia, quốc tế xử trí COPD như GOLD 2021 (58), Úc-Newzealand 2021 (59), Việt Nam 2021 (Vietnam guideline for COPD, VGFC) (60) đã đề cập tới trị liệu macrolide nhằm làm giảm đợt cấp trong COPD. Tài liệu GOLD nhấn mạnh khả năng làm tăng đáp ứng với trị liệu CRS khi điều trị kết hợp macrolide. Hiệu quả này sẽ rõ ràng hơn khi bệnh nhân ngưng hút thuốc lá (58). Nhìn từ thực tế, một nghiên cứu ở Bỉ (năm 2013) phân tích và kết luận điều trị macrolide liều thấp (dưới liều kháng sinh) dự phòng đợt cấp làm giảm đợt cấp nhập viện trên bệnh nhân COPD (GOLD II-IV) và từ đó làm giảm khoảng 38% chi phí chăm sóc y tế trong COPD (61).
KẾT LUẬN
Có vai trò quan trọng của nhiễm trùng mạn tính trên đường thở trong sinh bệnh học COPD nhưng ở các mức độ, cách tác động không giống nhau giữa bệnh nhân này và bệnh nhân khác. Macrolide, nhóm kháng sinh có cấu trúc vòng lactone 14 thành phần có khả năng tác dụng điều hòa miễn dịch và có các đặc tính dược động học tốt trong nhiễm trùng mạn tính đường thở. Khuyến cáo sử dụng kháng sinh nhóm macrolide trong điều trị COPD là nhằm tăng cường khả năng kiểm soát viêm, giảm đợt cấp, nhất là trên những trường hợp xác định bệnh có endotype nhiễm trùng. Ngay cả khi khả năng xuất hiện kháng thuốc, tác dụng phụ khi điều trị kéo dài đã được xem xét, macrolide điều trị liều thấp, kéo dài vẫn cần được cân nhắc, chỉ định trong nhưng trường hợp COPD không kiểm soát được bằng các trị liệu chuẩn, khi bệnh nhân có nhiều đợt cấp và có bằng chứng nhiễm trùng đường thở mạn tính. Xác định cơ chế viêm nền tảng nhiễm trùng trong COPD là xác định endotype. Sự chồng lấn endotype nhiễm trùng với các cơ chế viêm khác trong COPD như một bức tranh khảm, làm cho chẩn đoán và thực hành điều trị thực sự là một thách thức đòi hỏi năng lực chuyên khoa và còn cần nhiều nghiên cứu mang tính hướng dẫn thực hành tốt hơn.
Minh bạch:
- Tác giả bài viết không có mâu thuẫn lợi ích có liên quan tới bài viết cần thông báo.
- Tác giả đã sử dụng, vẽ và chú thích lại một số hình ảnh từ các bài viết của các tác giả khác (có chú thích trích dẫn).
TS.BS. Nguyễn Văn Thành
Trường Đại học Y-Dược Cần Thơ
Tài liệu tham khảo
|
1. |
Leopoldo N. Segal and Martin J. Blaser. A Brave New World: The Lung Microbiota in an Era of Change. Ann Am Thorac Soc Vol 11, Supplement 1, pp S21–S27, Jan 2014 |
|
2. |
James M. Beck. ABCs of the Lung Microbiome. Ann Am Thorac Soc Vol 11, Supplement 1, pp S3–S6, Jan 2014 |
|
3. |
Paul T King, Martin MacDonald and Philip G Bardin. Bacteria in COPD; their potential role and treatment. Translational Respiratory Medicine 2013, 1:13 |
|
4. |
M. Miravitlles. Exacerbations of chronic obstructive pulmonary disease: when are bacteria important?. Eur Respir J 2002; 20: Suppl. 36, 9s–19s |
|
5. |
Sanjay Sethi, Nancy Evans, Brydon J.B. Grant, and Timothy F. Murphy. New strains of bacteria and exacerbations of chronic obstructive pulmonary disease. N Engl J Med, Vol. 347, No. 7. August 15, 2002. |
|
6. |
Sanjay Sethi, Rohin Sethi, Karen Eschberge et al. Airway Bacterial Concentrations and Exacerbations of Chronic Obstructive Pulmonary Disease. Am J Respir Crit Care Med Vol 176. pp 356–361, 2007 |
|
7. |
M. Miravitlles, A. Marı´n, E. Monso´et al. Efficacy of moxifloxacin in the treatment of bronchial colonisation in COPD. Eur Respir J 2009; 34: 1066–1071 |
|
8. |
Sanjay Sethi, Paul W Jones, Marlize Schmitt Theron et al. Pulsed moxifloxacin for the prevention of exacerbations of chronic obstructive pulmonary disease: a randomized controlled trial. Respiratory Research 2010, 11:10 |
|
9. |
Yun Cai, Dong Chai, Rui Wang et al. Effectiveness and safety of macrolides in cystic fibrosis patients: a meta-analysis and systematic review. J Antimicrob Chemother 2011; 66: 968 –978 |
|
10. |
Eric Nuermberger and William R. Bishai. The Clinical Significance of Macrolide-Resistant Streptococcus pneumoniae: It’s All Relative. Clinical Infectious Diseases 2004; 38:99–103 |
|
11. |
Paolo Spagnolo, Leonardo M. Fabbri and Andrew Bush. Long-term macrolide treatment for chronic respiratory disease. Eur Respir J 2013; 42: 239–251 | DOI: 10.1183/09031936.00136712 |
|
13. |
G. W. Amsden. Anti-inflammatory effects of macrolides—an underappreciated benefit in the treatment of community-acquired respiratory tract infections and chronic inflammatory pulmonary conditions?. Journal of Antimicrobial Chemotherapy (2005) 55, 10–21 |
|
13. |
Marcus J. Schultz. Macrolide activities beyond their antimicrobial effects: macrolides in diffuse panbronchiolitis and cystic fibrosis. Journal of Antimicrobial Chemotherapy (2004) 54, 21–28 |
|
14. |
P.A.J. Crosbie and M.A. Woodhead. Review: Long-term macrolide therapy in chronic inflammatory airway diseases Eur Respir J 2009; 33: 171–181 |
|
15. |
Soichiro Kanoh and Bruce K. Rubin. Mechanisms of Action and Clinical Application of Macrolides as Immunomodulatory Medications. Clinical microbiology reviews, July 2010, p. 590–615 |
|
16. |
Hironobu Tsubouchi, Nobuhiro Matsumoto, Shigehisa Yanagi. Case report Successful treatment of chronic lower respiratory tract infection by macrolide administration in a patient with intralobar pulmonary sequestration and primary ciliary dyskinesia. Respiratory Medicine Case Reports Volume 15, 2015, Pages 62-65 |
|
17. |
Leonard B. Bacharier, Theresa W. Guilbert, David T. Mauger et al. Early Administration of Azithromycin and Prevention of Severe Lower Respiratory Tract Illnesses in Preschool Children With a History of Such Illnesses: A Randomized Clinical Trial. JAMA. 2015 November 17; 314(19): 2034–2044. doi:10.1001/jama.2015.13896. |
|
18. |
Suzuki T, Yanai M, Yamaya M, et al. Erythromycin and common cold in COPD. Chest 2001; 120: 730–733. |
|
19. |
Banerjee D, Khair OA, Honeybourne D. The effect of oral clarithromycin on health status and sputum bacteriology in stable COPD. Respir Med 2005; 99: 208–215. |
|
20. |
Seemungal TAR, Wilkinson TMA, Hurst JR, et al. Long-term erythromycin therapy is associated with decreased chronic obstructive pulmonary disease exacerbations. Am J Respir Crit Care Med 2008; 178: 1139–1147. |
|
21. |
Lydia J Finney, Andrew Ritchie, Elizabeth Pollard et al. Lower airway colonization and inflammatory response in COPD: a focus on Haemophilus influenzae International Journal of COPD 2014:9 1119–1132 |
|
22. |
Erb-Downward JR, Thompson DL, Han MK, Freeman CM, McCloskey L, Schmidt LA, Young VB, Toews GB, Curtis JL, Sundaram B, et al: Analysis of the lung microbiome in the “healthy” smoker and in COPD. PLoS One 2011, 6(2):e16384 |
|
23. |
Daniel J. Hassett, Michael T. Borcher, and Ralph J. Panos. Chronic Obstructive Pulmonary Disease (COPD): Evaluation From Clinical, Immunological and Bacterial Pathogenesis Perspectives. Journal of Microbiology (2014) Vol. 52, No. 3, pp. 211–226 |
|
24. |
Sanjay Sethi. Chronic Obstructive Pulmonary Disease and Infection Disruption of the Microbiome?. Ann Am Thorac Soc Vol 11, Supplement 1, pp S43–S47, Jan 2014 |
|
25. |
Moller LV, Timens W, van der-Bij W, Kooi K, de-Wever B, Dankert J, van-Alphen L: Haemophilus influenzae in lung explants of patients with end-stage pulmonary disease. Am J Respir Crit Care Med 1998, 157(3 Pt 1):950–956 |
|
26. |
Dromann D, Rupp J, Rohmann K, Osbahr S, Ulmer AJ, Marwitz S, Roschmann K, Abdullah M, Schultz H, Vollmer E, et al: The TGF-beta-pseudoreceptor BAMBI is strongly expressed in COPD lungs and regulated by nontypeable Haemophilus influenzae. Respir Res 2010, 11:67. |
|
27. |
King P: Haemophilus influenzae and the lung (Haemophilus and the lung). Clin Transl Med 2012, 1(1):10 |
|
28. |
Hogg JC, Chu F, Utokaparch S, Woods R, Elliott WM, Buzatu L, Cherniack RM, Rogers RM, Sciurba FC, Coxson HO, et al: The nature of small-airway obstruction in chronic obstructive pulmonary disease. N Engl J Med 2004, 350(26):2645–2653 |
|
29. |
Cosio MG, Saetta M, Agusti A: Immunologic aspects of chronic obstructive pulmonary disease. N Engl J Med 2009, 360(23):2445–2454 |
|
30. |
Leonard B Bacharier. Azithromycin During Wheezing Illnesses Among Preschool Children – Does the Airway Microbiota Provide Insights into Mechanism? AJRCCM Articles in Press. Published April 23, 2021 as 10.1164/rccm.202104-0842ED |
|
31. |
Chiara Colarusso, Michela Terlizzi, Antonio Molino et al. Role of the inflammasome in chronic obstructive pulmonary disease (COPD). www.impactjournals.com/oncotarget. Oncotarget Advance Publications 2017 (on line) |
|
32. |
Sethi S, Murphy TF. Infection in the pathogenesis and course of chronic obstructive pulmonary disease. N Engl J Med 2008;359: 2355–2365 |
|
33. |
Mart´ınez-Garc´ıa MA, de la Rosa Carrillo D, Soler-Cataluña JJ, DonatSanz Y, Serra PC, Lerma MA, Ballest´ın J, S ´anchez IV, Selma Ferrer MJ, Dalfo AR, et al. Prognostic value of bronchiectasis in patients with moderate-to-severe chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2013;187:823–831. |
|
34. |
Kim V, Criner GJ: Chronic bronchitis and chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2013, 187(3):228–237. |
|
35. |
I S Patel, TAR Seemungal, M Wilks et al. Relationship between bacterial colonisation and the frequency, character, and severity of COPD exacerbations. Thorax 2002;57:759–764 |
|
36. |
Mallia P, Footitt J, Sotero R, Jepson A, Contoli M, Trujillo-Torralbo MB, Kebadze T, Aniscenko J, Oleszkiewicz G, Gray K, et al: Rhinovirus infection induces degradation of antimicrobial peptides and secondary bacterial infection in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2012, 186(11):1117–1124 |
|
37. |
Susan V. Lynch. Viruses and Microbiome Alterations Ann Am Thorac Soc Vol 11, Supplement 1, pp S57–S60, Jan 2014 |
|
38. |
Michael G. Surette. The Cystic Fibrosis Lung Microbiome. Ann Am Thorac Soc Vol 11, Supplement 1, pp 61–65, Jan 2014 |
|
39. |
Shigeki Nakamura, Katsunori Yanagihara, Nobuko Araki et al. Efficacy of Clarithromycin against Experimentally Induced Pneumonia Caused by Clarithromycin-Resistant Haemophilus influenzae in Mice. Antimicrobial agents and chemotherapy, Feb. 2010, p. 757–762 |
|
40. |
Antonio Anzueto, Sandra Norris. Review: Clarithromycin in 2003: sustained efficacy and safety in an era of rising antibiotic resistance . International Journal of Antimicrobial Agents 24 (2004) 1–17 |
|
41. |
Anderson R, Theron AJ, Feldman C. Membrane-stabilizing, antiinflammatory interactions of macrolides with human neutrophils. Inflammation 1996;20:693–705. |
|
42. |
Rubin BK, Tamaoki J. Macrolide antibiotics as biological response modifiers. Curr Opin Invest Drugs 2000;1(2). |
|
43. |
Culic O, Erakovic V, Parnham MJ. Anti-inflammatory effects of macrolide antibiotics. Eur J Pharmacol 2001;429:209–29. |
|
44. |
Jaffe A, Bush A. Anti-inflammatory effects of macrolides in lung disease. Pediatr Pulmonol 2001;31:464–73. |
|
45. |
Zalewska-Kaszubska J, Gorska D. Anti-inflammatory capabilities of macrolides. Pharmacol Res 2001;44:451–4 |
|
46. |
George Carter, Lowell S. Young and Luiz E. Bermudez. A Subinhibitory Concentration of Clarithromycin Inhibits Mycobacterium avium Biofilm Formation. Antimicrobial agents and chemotherapy, dec. 2004, p. 4907–4910 |
|
47. |
Mark H. Gotfried, Larry H. Danziger, and Keith A. Rodvold. Steady-state plasma and bronchopulmonary characteristics of clarithromycin extended-release tablets in normal healthy adult subjects Journal of Antimicrobial Chemotherapy (2003) 52, 450–456 |
|
48. |
Nadine Hoffmann, Baoleri Lee, Morten Hentzer et al. Azithromycin Blocks Quorum Sensing and Alginate Polymer Formation and Increases the Sensitivity to Serum and Stationary-Growth-Phase Killing of Pseudomonas aeruginosa and Attenuates Chronic P. aeruginosa Lung Infection in Cftr-/- Mice. Antimicrobial agents and chemotherapy, oct. 2007, p. 3677–3687 |
|
49. |
Jun Tamaoki, Kiyoshi Takeyama, Etsuko Tagaya, and Kimio Konno. Effect of Clarithromycin on Sputum Production and Its Rheological Properties in Chronic Respiratory Tract Infections. Antimicrobial agents and chemotherapy, Aug. 1995, p. 1688–1690 |
|
50. |
Elsebeth Tvenstrup Jensen, Arsalan Kharazmi, Kan Lam et al. Human Polymorphonuclear Leukocyte Response to Pseudomonas aeruginosa Grown in Biofilms. Infection and immunity, July 1990, p. 2383-2385 |
|
51. |
Sanjay Sethi. Bacterial Infection and the Pathogenesis of COPD. CHEST 2000; 117:286S–291S |
|
52. |
J. Altenburg, C.S. de Graaff, T.S. van der Werf, W.G. Boersma. Immunomodulatory Effects of Macrolide Antibiotics – Part 1: Biological Mechanisms. Respiration 2011;81:67–74 DOI: 10.1159/000320319 |
|
53. |
Yolanda S Lo´ pez-Boado, Bruce K Rubin. Macrolides as immunomodulatory medications for the therapy of chronic lung diseases Current Opinion in Pharmacology 2008, 8:286–291 |
|
54. |
J. Altenburg, C.S. de Graaff, T.S. van der Werf, W.G. Boersma. Immunomodulatory Effects of Macrolide Antibiotics – Part 2: Advantages and Disadvantages of Long-Term, Low-Dose Macrolide Therapy. Respiration 2011;81:75–87 DOI: 10.1159/000320320 |
|
55. |
Elie Donath, Abubakr Chaudhry, Leonel F. Hernandez-Aya , Louis Lit. A meta-analysis on the prophylactic use of macrolide antibiotics for the prevention of disease exacerbations in patients with Chronic Obstructive Pulmonary Disease. Respiratory medicine 2013. 107, 1385-1392 |
|
56. |
Anthony W Huckle, Lucy C Fairclough, and Ian Todd. Prophylactic Antibiotic Use in COPD and the Potential Anti-Inflammatory Activities of Antibiotics. RESPIRATORY CARE • May 2018 vol 63 no 5 |
|
57. |
Richard K. Albert, John Connett, William C. Bailey et al. Azithromycin for Prevention of Exacerbations of COPD. N Engl J Med. 2011 August 25; 365(8): 689–698. doi:10.1056/NEJMoa1104623. |
|
58. |
2021 GOLD Reports - Global Initiative for Chronic Obstructive Lung Disease.https://goldcopd.org/2021-gold-report |
|
59. |
Lung Foundation Australia and the Thoracic Society of Australia and New Zealand. The COPD-X Plan: Australian and New Zealand Guidelines for the management of Chronic Obstructive Pulmonary Disease 2021 |
|
60. |
Tổng Hội Y Hội Việt Nam. Hướng dẫn quản lý và điều trị COPD Việt Nam 2021. Nxb Y học 2021. |
|
61. |
Steven Simoens, Gert Laekeman, Marc Decramer. Preventing COPD exacerbations with macrolides: A review and budget impact analysis. Respiratory Medicine. Volume 107, issue 5, p637-648, May 01, 2013 |