- Chi tiết
-
Được đăng: 02 Tháng 2 2019
1. Microbiome hô hấp
Microbiome cơ thể: Microbiome được định nghĩa như một tập hợp toàn bộ vi sinh vật đồng sinh, cộng sinh và gây bệnh tồn tại bên trong như đường tiêu hóa, miệng, mũi... hoặc trên bề mặt da của cơ thể người. Số lượng vi sinh vật trong microbiome cơ thể người khoảng 100 tỉ tỉ, nhiều gấp 10 lần số lượng toàn bộ các tế bào cơ thể và số gen vi khuẩn gấp 100 – 1000 lần số gen người. Quần thể microbiome không chỉ tồn tại song song ở cơ thể người mà có sự tương tác giữa microbiome và ký chủ: microbiome mang lại một số chức năng chuyển hóa cho cơ thể ký chủ (1).
Microbiome hô hấp: Quan niệm t>rước đây cho rằng ở người bình thường, đường hô hấp từ thanh môn trở xuống là hoàn toàn vô khuẩn dù cho có sự liên tiếp với đường dẫn khí trên, sự kế cận với ống tiêu hóa và sự tiếp xúc thường xuyên với môi trường bên ngoài qua hơi thở. Hiện tượng này là do phổi có nhiều cơ chế bảo vệ để hạn chế vi khuẩn sinh sống và phát triển. Tuy nhiên gần đây những kỹ thuật vi sinh không liên quan đến cấy (ex: kỹ thuật giải trình tự gen 16S rRNA) ra đời cho thấy có sự hiện diện của nhiều loại vi khuẩn ở phổi người bình thường khỏe mạnh không hút thuốc, trong đó chỉ có 30% vi khuẩn được phát hiện bằng kỹ thuật cấy cổ điển. >Nhờ đó, bức tranh về cộng đồng vi khuẩn hoàn chỉnh trong môi trường ở phổi dần dần được hình thành (2).
Nhiều nghiên cứu đã chứng minh có sự hiện diện của vi khuẩn trong đường hô hấp dưới với số lượng ít (100 – 1000/ ml dịch rửa phế quản) so với vi khuẩn đường tiêu hóa do tại phổi có ít chất dinh dưỡng hơn và trên bề mặt phế nang có chất surfactant giàu lipid có tính kiềm khuẩn. Thành phần của vi khuẩn trong microbiome phổi tương tự với vi khuẩn thường trú ở vùng hầu họng cho thấy vi khuẩn vào phổi do hiện tượng microaspiration trong khi ngủ.
Có nhiều yếu tố ảnh hưởng đến sự hiện diện của vi khuẩn ở phổi, bao gồm các yếu tố liên quan đến hiện tượng xâm nhập vi khuẩn vào phổi (như hít thở không khí có chứa vi khuẩn vào phổi, microaspiration trong khi ngủ hay do rối loạn nuốt, sự phân tán của vi khuẩn trên niêm mạc phế quản...) hay hiện tượng loại bỏ vi khuẩn ra khỏi phổi (như phản xạ ho, thanh thải đàm nhày của biểu mô – lông chuyển, khả năng bảo vệ của cơ thể và của phổi..). Các yếu tố ảnh hưởng đến sự phát triển tại chỗ của vi khuấn cũng rất quan trọng bao gồm nguồn dinh dưỡng cho vi khuẩn, nhiệt độ, pH, áp lực oxy, số lượng tế bào viêm và khả năng kích hoạt các tế bào viêm tại chỗ, sự cạnh tranh với hệ vi khuẩn tại chỗ và sự tương tác của tế bào biểu mô và vật chủ... (3) (Hình 1).
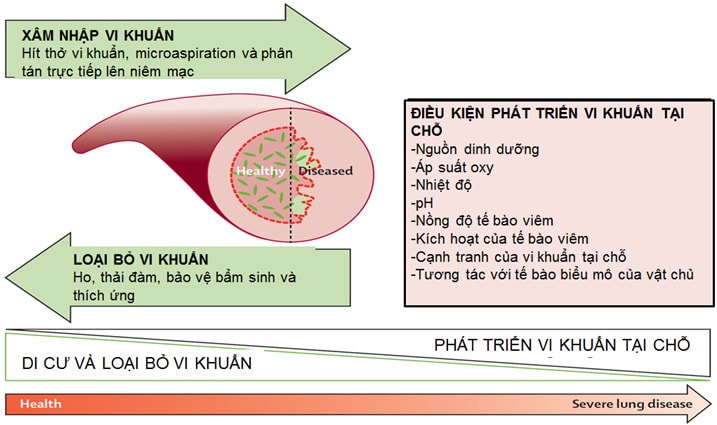
Hình 1: Các yếu tố ảnh hưởng đến thành phần vi khuẩn trong microbiome phổi
>2. Microbiome hô hấp và COPD
>Các nghiên cứu trước đây bằng phương pháp >cấy vi khuẩn >cổ điển cho thấy> có sự gia tăng >hiện diện của nhiều loại vi khuẩn>, bao gồm cả các vi khuẩn >gây bệnh ở đường hô hấp dưới ở khoảng 30 – 50% >bệnh nhâ>n COPD trong giai đoạn >ổn định và gia tăng tái xuất hiện các vi khuẩn cơ hội như Pseudomonas aeroginosa. Các vi khuẩn náy >được mệnh danh là vi khuẩn> định cư (colonizing bacteria), và có liên quan với đáp ứng viêm, giảm chức năng hô hấp và gia tăng triệu chứng thường ngày của bệnh nhân COPD. Sự hiện diện của vi khuẩn ở đường hô hấp dưới của bệnh nhân COPD cho thấy cơ chế đề kháng của vật chủ bị phá vỡ. Viêm toàn thể và viêm đường dẫn khí vốn là cơ chế bệnh sinh chính của COPD đã làm thay đổi tính ổn định của hệ microbiome tại phổi (dysbiosis), làm phản ứng viêm nặng nề hơn và microbiome phổi mất ổn định nhiều hơn.
Giả thuyết “Vòng xoắn bệnh lý”: Phơi nhiễm khói thuốc lá hay chất đốt sinh khối làm thay đổi cơ chế bảo vệ tại phổi dẫn đến một số vi khuẩn gây bệnh có thể xâm nhập, tồn tại và phát triển ở đường hô hấp dưới bằng cách hít vào hay microaspiration. Những vi khuẩn này truyền tín hiệu thông qua nhiều thụ thể trên niêm mạc đường dẫn khí và tế bào miễn dịch và gây nên hiện tượng viêm nhằm cố gắng loại trừ vi khuẩn. Tuy nhiên, hiện tượng viêm này lại hủy hoại nặng thêm cơ chế bảo vệ tại phổi, để cho vi khuẩn gây bệnh tồn tại và phát triển nhiều hơn nữa trong phổi và tạo thành ‘vòng xoắn bệnh lý’. Vòng xoắn của viêm và nhiễm khuẩn mạn tính này dẫn đến hư hỏng và mất chức năng phổi đặc trưng của COPD ngay cả khi nguyên nhân gây bệnh đã được loại bỏ (4)(Hình 2).
Các nghiên cứu dùng những kỹ thuật vi sinh không liên quan đến phương pháp cấy gần đây trên bệnh nhân COPD ổn định cho thấy có sự hiện diện thường xuyên nhưng không thuần nhất của microbiome trong phổi với Pseudomonas, Haemophilus hoặc Stenotrophomonas spp chiếm ưu thế. Khảo sát thành phần của vi khuẩn/ microbiome cho thấy có giảm tính đa dạng so với người bình thường và tình trạng giảm tính đa dạng này có liên quan đến gia tăng độ nặng của COPD.
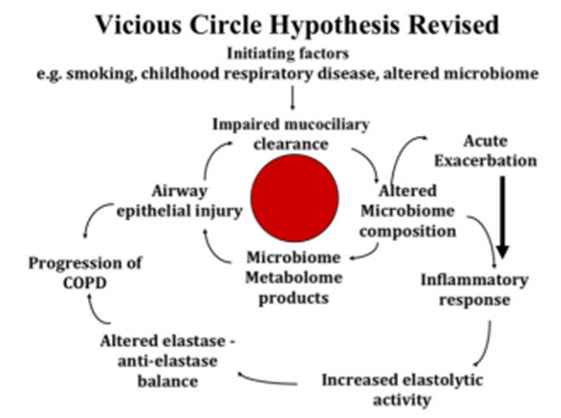
Hình 2: Vòng xoắn bệnh lý trong cơ chế bệnh sinh COPD (4)
Trong đợt cấp COPD, một số nghiên cứu cho thấy tỉ lệ nhiễm khuẩn và tải lượng vi khuẩn không gia tăng. Vi khuẩn được tìm thấy trong bệnh phẩm đường hô hấp cả trong và ngoài đợt cấp cho thấy sự hiện diện của vi khuẩn không hẳn là nguyên nhân đợt cấp trong một số trường hợp (5). Những nghiên cứu băng kỹ thuật giải trình tự gen 16S rRNA gần đây cho thấy trong đợt cấp COPD, có hiện tượng giảm nhẹ và không có ý nghĩa thống kê tính đa dạng vi khuẩn so với lúc ổn định, đồng thời có sự tăng nhẹ Proteobacteria (Haemophilus) và giảm nhẹ Firmicute (Streptococcus).(6,7)(Hình 3)
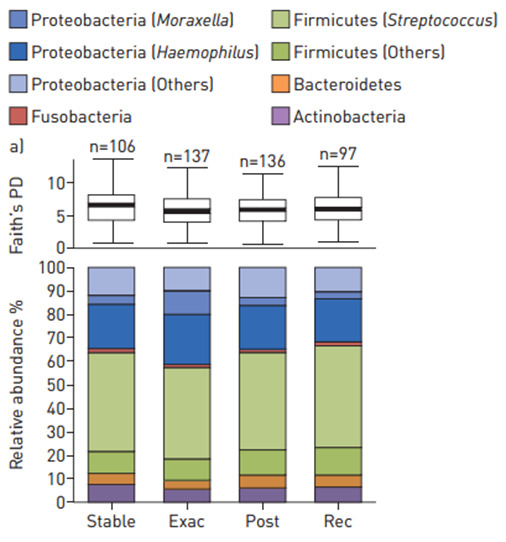
Hình 3: Tính đa dạng và thành phần vi khuẩn ở 4 thời điểm: ổn định, đợt cấp, sau điều trị và hồi phục.(7)
>3. >Kiểu hình COPD:
>COPD là một bệnh lý không thuần nhất. Các nhóm bệnh nhân COPD có biểu hiện lâm sàng rất khác nhau: ngoài tắc nghẽn luồng khí là rối loạn cơ bản tại phổi>, các biểu hiện ngoài phổi của bệnh thường không giống nhau, phân độ và tiên lượng bệnh không chỉ dựa vào FEV1 mà còn nhiều yếu tố khác (mức độ khó thở, chất lượng cuộc sống>, nguy cơ đợt cấp, bệnh lý đồng mắc...). >Bệnh nhân COPD cũng không đáp ứng hoàn toàn như nhau đối với các loại thuốc. >Có nhiều bằng chứng cho thấy COPD là một bệnh lý đa kiểu hình có thể liên quan đến tuổi tác, lối sống, kiểu di truyền và phơi nhiễm môi trường,> vì vậy >cần nhận diện những kiểu hình bao gồm những nhóm bệnh nhân có đáp ứng với những biện pháp điều trị khác nhau để có hướng điều trị thích hợp>. K>iểu hình COPD được đ>ịnh nghĩa như >là một nhóm các thuộc tính bệnh mô tả sự khác biệt của các nhóm bệnh nhân COPD có liên quan đến các kết cục lâm sàng khác nhau >(triệu chứng, đợt cấp, đáp ứng điều trị, tốc độ diễn tiến bệnh và tử vong). Một số> kiểu hình được đề nghị> như: Đợt cấp thường xuyên; Viêm phế quản mạn và tăng tiết đàm; Khí phế thủng và căng phồng phổi quá mức; Hội chứng chồng lắp; Viêm toàn thể và bệnh đồng mắc; Sụt giảm nhanh FEV1... >Kiểu hình và tiếp cận điều trị theo kiểu hình COPD >giúp đánh giá điều trị và tiên lượng bệnh tốt hơn vì vậy >cần được chú ý xem xét, có thêm nhiều cơ sở dữ liệu lâm sàng để hướng tới điều trị hiệu quả và hợp lý hơn.
4. Kiểu hình đợt cấp COPD:
Theo GOLD 2018, đợt cấp COPD được định nghĩa “là tình trạng diễn biến xấu hơn cấp tính của các triệu chứng hô hấp dẫn đến phải thêm thuốc điều trị”. >Hậu quả của các đợt cấp COPD làm cho bệnh nhân viêm đường thở nhiều hơn, sụt giảm nhanh chức năng hô hấp>, chất lượng cuộc sống kém, gia tăng tỉ lệ tử vong và cuối cùng là tăng chi phí kinh tế - xã hội.
>Các yếu tố sau làm gia >tăng nguy cơ vào đợt cấp của bệnh nhân COPD>:
Lớn tuổi
COPD nặng (khó thở nhiều, FEV1 thấp, paO2 thấp)
Tiền sử nhiều đợt cấp
Dùng kháng sinh và corticosteroid> toàn thân trong năm qua
Tăng tiết nhiều đàm
Vi khuẩn định cư ngoài đợt cấp
Bệnh lý đồng mắc (bệnh tim mạch, yếu cơ, trào ngược dạ dày- thực quản>).
Nguyên nhân cúa các đợt cấp rất đa dạng: liên quan đến sinh học (viêm, nhiễm virus hô hấp, nhiễm vi khuẩn hô hấp, đồng nhiễm vi khuẩn – virus...); liên quan đến bệnh lý lâm sàng (các bệnh lý đồng mắc, suy tim, thuyên tắc phổi, kém đáp ứng với điều trị...); liên quan đến các yếu tố xã hội (tuân thủ điều trị kém, điều kiện kinh tế - xã hội kém, ít hỗ trợ gia đình...) và cuối cùng là không rõ nguyên nhân, trong đó các nguyên nhân liên quan đến viêm nhiễm chiếm đa số. Biểu hiện của các đợt cấp COPD cũng rất thay đổi: một số đợt cấp liên quan đến viêm đường thở do neutrophil, một số đợt cấp khác có hiện tượng viêm gia tăng eosinophil(8). Cũng tương tự như khái niệm kiểu hình COPD, đợt cấp COPD cũng là những biến cố có biểu hiện không đồng nhất và người ta có khuynh hướng phân chia thành các phụ nhóm gọi là các kiểu hình đợt cấp COPD và có các hướng điều trị khác nhau.
Gao và cộng sự khảo sát tế bào trong đàm của bệnh nhân trong đợt cấp COPD và phân chia thành 4 phụ nhóm của đợt cấp COPD: đợt cấp tăng eosinophil, đợt cấp tăng neutrophil, dợt cấp có tế bào hỗn hợp và dợt cấp có ít tế bào, trong đó 83% bệnh nhân trong nhóm tăng neutrophil có bằng chứng của nhiễm vi khuẩn và nhiều người có đáp ứng kém với điều trị. Bệnh nhân có đợt cấp nhóm tăng neutrophil và nhóm hỗn hợp có chức năng hô hấp kém và tăng viêm nhiều hơn so với các nhóm khác(9).
Bafadhel và cộng sự khảo sát 182 đợt cấp trên 86 bệnh nhân COPD bao gồm các đợt cấp do nhiễm vi khuẩn (phân lập có vi khuẩn bằng phương pháp cấy > 107 CFU; đợt cấp do nhiễm virus khi tìm thấy virus trong đàm bằng phương pháp PCR, đợt cấp đồng nhiễm vi khuẩn – virus và đợt cấp tăng eosinophil (>3% eosinophil/ đàm) và khảo sát các chất đánh dấu sinh học trong máu và trong đàm. Để khảo sát 3 kiểu viêm khác nhau (pro-inflammatory, Th1 và Th2), tác giả dùng 3 chất đánh dấu sinh học (TNF RII, CXCL11 và CCL17) để phân các đợt cấp thành 4 cụm (kiểu hình): đợt cấp nhiễm vi khuẩn ưu thế, đợt cấp nhiễm virus ưu thế, đợt cấp tăng eosinophil ưu thế và đợt cấp ít tế bào viêm(10).
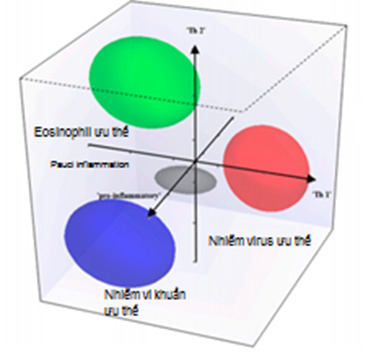
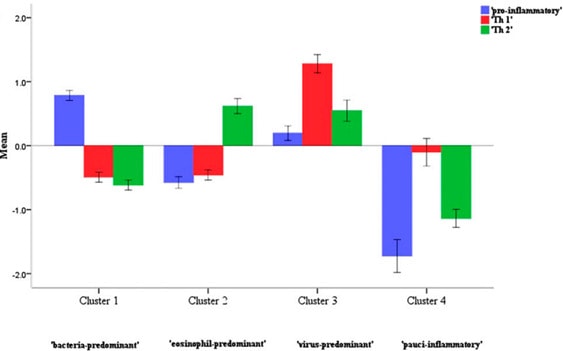
Hình 4: Phân nhóm đợt cấp theo Bafadhel(10)
Để xác định nhóm đợt cấp nhiễm vi khuẩn chiếm ưu thế, chất đánh dấu sinh học được đề nghị là IL 1β với giá trị ngưỡng là 125pg/ml (độ nhạy 90%, độ đặc hiệu 80%). Tương tự, đối với nhóm đợt cấp nhiễm virus chiếm ưu thế là dùng CXCL 10 với giá trị ngưỡng 56pg/ml (độ nhạy 75%, độ đặc hiệu 65%); đối với đợt cấp eosinophil ưu thế, eosinophil trong máu > 2 % có độ nhạy 90% và độ đặc hiệu 60%)(10).
Tác giả Lopez Campos đề nghị phân nhóm đợt cấp vừa dựa trên độ nặng của đợt cấp trên lâm sàng (thang điểm BAP65 hay DeCOPD hay Roche), vừa dựa trên các yếu tố phân nhóm theo bệnh học (eosinophil /đàm và đàm mủ) để xếp thành 4 nhóm tương tự bảng phân nhóm ABCD của GOLD cho bệnh nhân COPD ổn định(11).
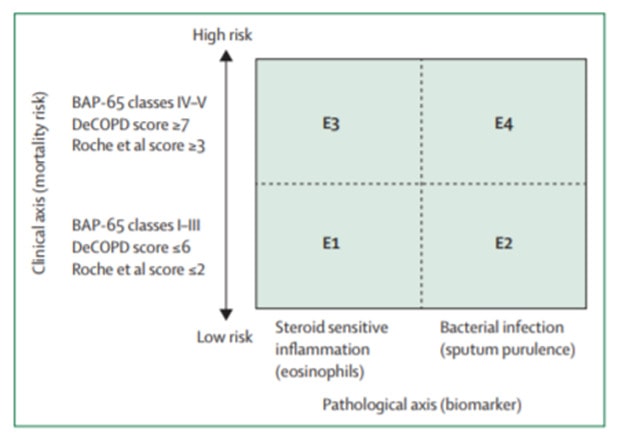
Hình 5: Phân nhóm đợt cấp theo Lopez Campos (11)
Phân chia kiểu hình đợt cấp COPD nhằm hướng đến việc tiếp cận điều trị hiệu quả hơn, ví dụ kiểu hình tăng eosinophil ưu thế có lẽ sẽ đạt hiệu quả tốt khi điều trị với corticosteroid trong khi nhóm nhiễm vi khuẩn ưu thế theo lý luận sẽ chỉ hiệu quả với kháng sinh mà không cần sử dụng corticosteroid. Tuy nhiên vẫn chưa có những thử nghiệm lâm sàng hướng đến việc điều trị đợt cấp theo kiểu hình. Một số nghiên cứu cho thấy kháng sinh và corticosteroid làm thay đổi microbiome ở bệnh nhân COPD: giảm tính đa dạng biểu hiện bởi giảm Streptococcus và gia tăng Haemophilus và Moraxella ở những đối tượng được điều trị với corticosteroid đơn thuần; và ngược lại đối với những bệnh nhân được điều trị với kháng sinh. Tình trạng này vẫn tiếp tục duy trì sau khi đã ngưng thuốc(7).
Kết luận
Có sự hiện diện của vi khuẩn trong phổi người bình thướng gọi là microbiome hô hấp và tính đa dạng và thành phần của microbiome thay đổi đáng kể trong các bệnh lý phổi mạn tính như COPD. COPD là một bệnh lý không thuần nhất và các đợt cấp COPD cũng không thuần nhất và bao gồm nhiều kiểu hình khác nhau. Kiểu hình đợt cấp COPD được phân chia ra sao, vai trò của microbiome hô hấp trong diễn tiến của bệnh COPD và các đợt cấp COPD, cách tiếp cận điều trị đợt cấp COPD theo kiểu hình là những vấn đề còn đang được nghiên cứu.
TS BS Đỗ thị Tường Oanh
TÀI LIỆU THAM KHẢO
1. Gates K, Martinez F. The human microbiome in the lung. Chronic Obstr Pulm Dis (Miami). 2016; 3(1):466-472.
2. Sze MA, Hogg JC, Sin DD. Bacterial microbiome of lungs in COPD. Int J COPD 2014:9 229–238.
3. MK Han, YJ Huang, FJ Martinez. Significance of the microbiome in obstructive lung disease. Thorax 2012;67:456e463. doi:10.1136/thoraxjnl-2011-201183.
4. Mammen M, Sethi S. COPD and the microbiome. Respirology 2016 (21): 590 – 599.
5. Patel IS, Seemungal TAR, Wilks M, Lloyd-Owen SJ, Donaldson GC, Wedzicha JA. Relationship between bacterial colonisation and the frequency, character, and severity of COPD exacerbations. Thorax 2002;57:759–764.
6. Beasley V, Joshi PV, Singanayagam A, Molyneaux PL, Johnston SL, Mallia P. Lung microbiology and exacerbations in COPD; Int J COPD 2012:7 555–569.
7. Wang Z, Bafadhel M, Haldar K, Spivak A, Mayhew D, Miller BE, Tal-Singer R, Johnston SL,
Ramsheh MY, Barer MR, Brightling CE, Brown JR. Lung microbiome dynamics in COPD exacerbations Eur Respir J 2016; 47: 1082–1092 | DOI: 10.1183/13993003.01406-2015
8. MacDonald M, Korman T, King P, Hamza K. Exacerbation phenotyping in COPD. Respirology 2013 (18): 1280 – 1281, doi: 10.1111/resp 12197
9. Gao P, Zhang J, He X, Hao Y, Wang K, Gibson PG. Sputum inflammatory cell-based classification of patients with acute exacerbation of chronic obstructive pulmonary disease. PloS One 2013; 8: e57678.
10. Bafadhel M, McKenna S, Terry S, et al. Acute exacerbations of chronic obstructive pulmonary disease: identification of biologic clusters and their biomarkers. Am J Respir Crit Care Med 2011; 184: 662–71.
11. Lopez-Campos JL, Agustí A. Heterogeneity of chronic obstructive pulmonary disease exacerbations: a two-axes classification proposal. Lancet Respir Med 2015; 3: 729–34. http://dx.doi.org/10.1016/ S2213-2600(15)00242-8
12. Zhou A, Zhou Z, Zhao Y, Chen P. The recent advances of phenotypes in acute exacerbations of COPD. International Journal of COPD 2017:12 1009–1018